
有机物X只含C、H、O三种元素,其相对分子质量不超过100,若X中所含氧元素的质量分数为36.36%,则能与NaOH溶液发生反应的X共有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:填空题
A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去)。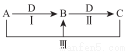
(1)若A为氯碱工业的产品,C为厨房中常用的发酵粉的成分常用于食品膨松剂。
①反应Ⅲ的离子方程式是_________________________;
②氯碱工业制程A的化学方程式是_________________________,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1 mol KI 转移电子0. 6mol,则三种物质间反应的离子方程式是___________;
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是_________________________;
②B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是____________。
查看答案和解析>>
科目:高中化学 来源:2016届青海省西宁市等校高三下联考理综化学试卷(解析版) 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(假设杂质中不含铁元素和氧元素,且杂质不与稀硫酸反应)。某研究性学习小组对某铁矿石中铁的价态和氧化物的化学式进行探究。
[提出假设]
假设1:铁矿石中只含+3价铁;
假设2:铁矿石中只含+2价铁;
假设3:_____________________________________________。
[查阅资料]2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
[定性探究]
实验(一)
取铁矿石样品粉碎,盛装于烧杯中,加入适量的X溶液,微热,充分溶解后将滤液分成四份:
①向第一份溶液中滴加少量KSCN溶液;
②向第二份溶液中滴加适量高锰酸钾溶液;
③向第三份溶液中滴加少量KSCN溶液,再滴加适量过氧化氢溶液;
④向第四份溶液中滴加适量氢氧化钠溶液。
(1)上述X溶液是________(填“稀硝酸”“稀硫酸”或“浓盐酸”);上述方案中,一定能证明铁矿石中含+2价铁的方案是________(填序号)。
[定量探究]
实验(二) 铁矿石中含氧量的测定:
①按图组装仪器,检查装置的气密性;
②将5.0 g铁矿石放入硬质玻璃管中,其他装置中的药品如图所示(夹持装置已略去);
③A中开始反应,不断地缓缓向后续装置中通入氢气,待D装置出口处氢气验纯后,点燃C处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气直至完全冷却。
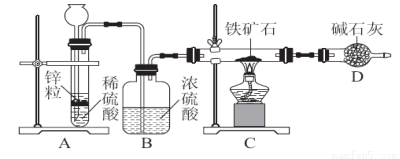
(2)按上述方案进行多次实验,假设各项操作都正确,但最终测得结果都偏高,请你提出改进方案的建议:____________________________________________________。
如果拆去B装置,测得结果可能会________(填“偏高”“偏低”或“无影响”)。
(3)改进方案后,测得反应后D装置增重1.35 g,则铁矿石中氧的百分含量为________。若将H2换成CO,则还需补充________装置。
实验(三) 铁矿石中含铁量的测定:
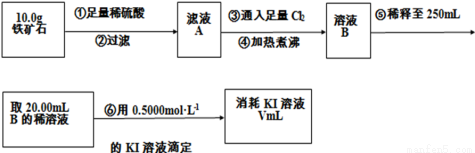
(4)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、______________。
(5)步骤④中煮沸的作用是_________________________________________。
(6)若滴定过程中消耗0.500 0 mol·L-1的KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:选择题
某有机原料的结构简式如图: 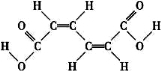 下列有关该有机物的叙述正确的是
下列有关该有机物的叙述正确的是
A.已知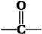 为平面结构,则该有机物分子中最多有16个原子在同一平面内。
为平面结构,则该有机物分子中最多有16个原子在同一平面内。
B.1mol该有机物可以和2mol NaOH反应,但不能用Na2CO3溶液区分该有机物和CH3COOCH2CH3[
C. 该有机物能发生加成反应不能发生取代反应
D. 该有机物与乙酸互为同系物
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市高三下高考第一次模拟理综化学试卷(解析版) 题型:实验题
醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
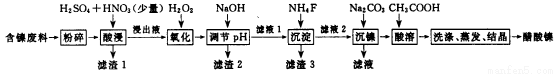
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)调节pH步骤中,溶液pH的调节范围是____________。
(2)滤渣1和滤渣3主要成分的化学式分别是____________、_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式_____________。
(4)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式_______________。
(5)沉镍过程中,若c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为______g。(保留小数点后1位有效数字)

(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为________℃、_______min。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:实验题
某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g·mL﹣1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1) 加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是 混合液体时最后加入浓硫酸的理由: 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点最好采用装置 (填“甲”或“乙”或“丙”)。
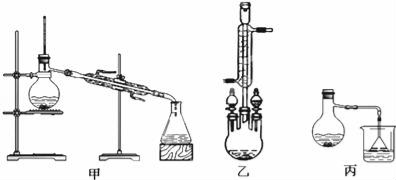
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称,操作Ⅱ 。


(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是 。
(6)列式计算,苯甲酸甲酯的产率是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:选择题
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )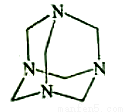
A.1:1 B.2:3 C.3:2 D.2:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:选择题
洗涤做过银镜反应的试管时,所用的试剂是( )
A.氨水 B.NaOH溶液 C.硝酸 D.酒精
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二下期中化学试卷(解析版) 题型:选择题
分子式为C6H12,且含有3个—CH3原子团的烯烃共有( )(不考虑顺反异构)
A.2种 B.3种 C.4种 D. 5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com