
| A、常温下,23gNO2含有nA个氧原子 |
| B、1molFe与足量的稀HNO3反应转移2nA个电子 |
| C、常温常压下,22.4LCCl4含有nA个CCl4分子 |
| D、1molFe2+与 足量H2O2溶液反应,转移2nA个电子 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
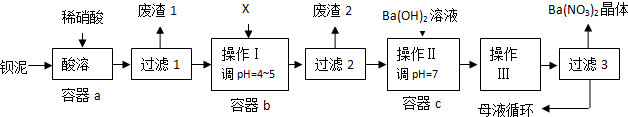
查看答案和解析>>
科目:高中化学 来源: 题型:
A、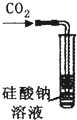 此装置:可用来证明碳的非金属性比硅强 |
B、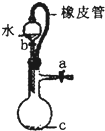 此装置:橡皮管的作用是平衡压强,使水顺利流下 |
C、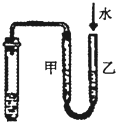 此装置:用图示的方法能检查此装置的气密性 |
D、 此装置:可收集二氧化碳或氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
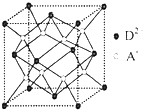 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态 |
| D、使用过量的H2或升高温度都可以提高SiCl4的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com