
| A. | 乙醇燃烧 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 甲烷和氯气混合,见光 | D. | 用乙醇、乙酸与浓H2SO4混合加热 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
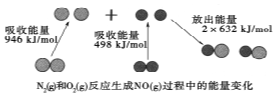 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | 在1L的容器中发生反应,10min内 N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L•min) | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 存在有能使溴的四氯化碳溶液褪色的同分异构体 | |
| D. | 存在分子中含有五元环的酯类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com