
| A. | 0.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| B. | 在标准状况下,2.24L乙烷中含有的化学键数为0.6NA | |
| C. | 100mL 0.1mol•L-1 Na2SO4溶液中含有的O原子数为0.04NA | |
| D. | 25℃时,1.0L pH=3的CH3COOH溶液中含有的H+数小于10-3 NA |
分析 A.镁为2价金属,0.1mol镁完全反应无论生成氧化镁还是氮化镁,都转移了0.2mol电子;
B.1个乙烷分子中含有6个C-H和1个C-C;
C.硫酸钠溶液中硫酸钠、水中都含有氧原子;
D.依据n=CV结合pH=-lg[H+]解答.
解答 解:A.镁为2价金属,0.1mol镁完全反应无论生成氧化镁还是氮化镁,都转移了0.2mol电子,转移的电子数为0.2NA,故A正确;
B.在标准状况下,2.24L乙烷物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,中含有的化学键数为0.7NA,故B错误;
C.100mL 0.1mol•L-1 Na2SO4溶液中含有的O原子数远远大于0.04NA,故C错误;
D.25℃时,1.0L pH=3的CH3COOH溶液中,C(H+)=10-3mol/L,含有的H+数=1.0L×10-3mol/L×NA=10-3 NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意乙烷结构、注意溶液pH值相关计算,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | |
| B. | NaHCO3电离:NaHCO3?Na++HCO3- | |
| C. | 一水合氨电离:NH3•H2O═NH4++OH- | |
| D. | 过量的CO2气体通入饱和石灰水中:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
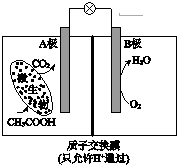
| A. | 外电路电子从B极移向A极 | |
| B. | 溶液中H+由B极区移向A极区 | |
| C. | 电池工作一段时间后B极区溶液的pH减小 | |
| D. | A极电极反应式为:CH3COOH-8e-+2H2O=2CO2+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维遇强碱会“断路” | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
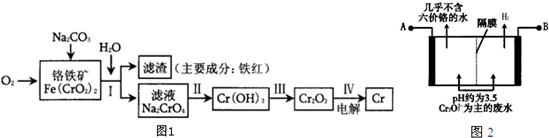
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
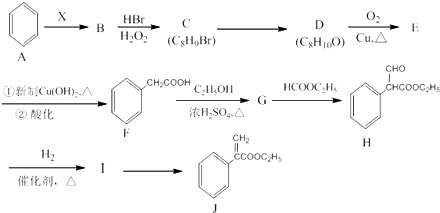
 .
.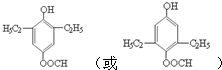 (任写一种即可).
(任写一种即可).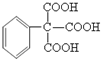 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).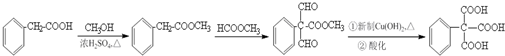 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
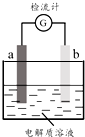 30℃时,利用图装置进行实验,结果记录如下表所示:
30℃时,利用图装置进行实验,结果记录如下表所示:| 实验 | a电极 | b电极 | 电解质溶液 | 现象 |
| I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅱ | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅲ | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
| Ⅳ | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
| A. | Ⅱ中Al为负极,其电极反应是:Al-3e-═Al3+ | |
| B. | Ⅱ中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行 | |
| C. | Ⅳ中Fe为负极,发生了氧化反应 | |
| D. | 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当滴入20mL NaOH溶液时:c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| D. | 当滴入30mL NaOH溶液时,所得溶液pH>7:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com