
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 化学名词:乙酸乙脂、笨、油酯、坩埚 | |
| C. | 如图是某一种物质的结构简式是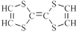 ,则该物质是一种烃 ,则该物质是一种烃 | |
| D. | 聚乙烯的化学组成表示式为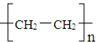 |
科目:高中化学 来源: 题型:解答题

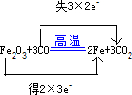 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喷水冷却燃烧物,冷却灭火 | B. | 沙土覆盖燃烧物,窒息灭火 | ||
| C. | 移开易燃易爆物,隔离灭火 | D. | 喷入化学灭火剂,抑制灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成3种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
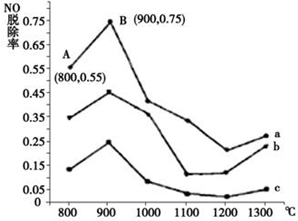 硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.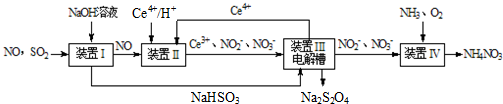
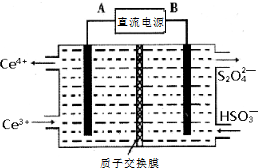
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com