
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| C、硫酸溶液中加入铁粉:2Fe+6H+=2Fe3++3H2O |
| D、碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、向FeCl3溶液中加入镁粉有气泡产生 |
| B、NO2溶于水得到HNO3,所以NO2属于酸性氧化物 |
| C、C12、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| D、向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲苯含有6NA个C-H键 |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA |
| C、标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
| D、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 |
| B、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| C、鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
| D、焰火“脚印”、“笑脸”,使北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”的知识相关,焰色反应是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40 gNaOH溶于1L水中,所得NaOH溶液的浓度为1 mol?L-1 | ||
| B、将2.3gNa投入到97.7g水中充分反应,所得溶液中溶质的质量分数为4.0% | ||
C、在t℃时,将a g NH3完全溶液水,得到VmL溶液.该溶液的物质的量浓度为
| ||
| D、1 mol?L-1的硫酸溶液中c(H+)=1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
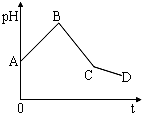 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A、整个过程中阳极先产生Cl2,后产生O2 |
| B、阳极极产物一定是Cl2,阴极产物一定是Cu |
| C、BC段表示在阴极上是H+放电产生了H2 |
| D、CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com