
| A. | HCl+Zn,Zn+NaHSO4 | B. | Cu(OH)2+H2SO4,Cu(OH)2+HNO3 | ||
| C. | CaO+HCl,CaO+HNO3 | D. | BaCl2+NaHSO4,Ba(OH)2+NaHSO4(少量) |
分析 A.两个反应的实质都是Zn与氢离子反应生成氢气和锌离子;
B.氢氧化铜为难溶物,离子方程式中需要保留化学式,两个反应实质为氢氧化铜与氢离子反应生成铜离子和水;
C.两个反应实质都是氧化钙与氢离子反应生成钙离子和水;
D.前者只有硫酸钡沉淀生成,而后者除了硫酸钡沉淀还生成水.
解答 解:A.HCl+Zn、Zn+NaHSO4的离子方程式都为:Zn+2H+=Zn2++H2↑,故A不选;
B.Cu(OH)2+H2SO4,Cu(OH)2+HNO3的离子方程式都为:Cu(OH)2+2H+=2H2O+Cu2+,故B不选;
C.CaO+HCl,CaO+HNO3的离子方程式都为:CaO+2H+=H2O+Ca2+,故C不选;
D.BaCl2+NaHSO4的离子方程式为:SO42-+Ba2+=BaSO4↓,Ba(OH)2+NaHSO4(少量)的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O,它们不能用同一离子方程式表示,故D选;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度不大,明确离子方程式表示的意义为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及规范答题能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以区分羊毛和人造纤维 | |
| B. | 医用消毒酒精是体积分数为95%的乙醇 | |
| C. | 食用一定量的油脂能促进人体对某些维生素的吸收 | |
| D. | 加热能杀死流感病毒是因为蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
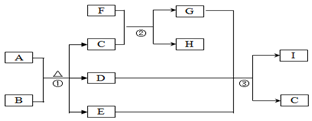 有关物质的转化关系如图所示(部分生成物与反应条件已略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.
有关物质的转化关系如图所示(部分生成物与反应条件已略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体. .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H=-283.0 kJ/mol | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H${\;}_{2}^{16}$O、D${\;}_{2}^{16}$O、H${\;}_{2}^{18}$O、D${\;}_{2}^{18}$O互为同位素 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均相似 | |
| C. | 石墨烯(结构如图 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
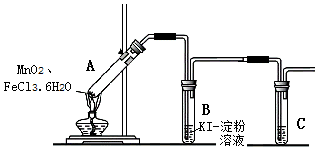
| 操作 | 现象 |
| (1)经检查,装置气密性良好. (2)添加药品,连接装置. (3)点燃酒精灯. | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com