
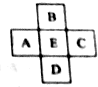
 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
分析 如果D与E、E与D相差原子序数相同时,四种元素的原子序数之和为4x;
如果E是第三周期第IIIA族到第VIIA族元素,D和E原子序数相差18,B和E原子序数相差8;
如果E是第四周期Ca元素,D和E原子序数相差8,B和E原子序数相差18;
如果E是第四周期第IIIA族到第VIIA族元素,D和E原子序数相差18、B和E原子序数相差18;
如果这几种元素都是副族元素,且E是第五周期第IVB族到第VIII族、第IB族时,B和E原子序数相差18、E和D原子序数相差32,据此进行解答.
解答 解:如果D与E、E与D相差原子序数相同时,则A、B、C、D四种元素的原子序数之和为4x;
如果E为第三周期第IIIA族到第VIIA族元素,D和E原子序数相差18,B和E原子序数相差8,则A、B、C、D四种元素的原子序数之和为4x+10;
如果E是第四周期Ca元素,B和E原子序数相差8,D和E原子序数相差18,则A、B、C、D四种元素的原子序数之和为4x+10;
如果E是第四周期第IIIA族到第VIIA族元素,D和E原子序数相差18、B和E原子序数相差18,A、B、C、D四种元素的原子序数之和为4x;
如果这几种元素都是副族元素,且E是第五周期第IVB族到第VIII族、第IB族时,B和E原子序数相差18、E和D原子序数相差32,则A、B、C、D四种元素的原子序数之和为4x+14,
通过以上分析知,A、B、C、D四种元素原子序数之和不可能为4x+6,
故选B.
点评 本题考查元素周期表结构及元素在周期表中的位置,题目难度中等,试题侧重考查学生分析问题能力、发散思维能力,采用假设方法对元素进行分析,注意同一主族相邻元素原子序数之差.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在玻璃瓶中 | B. | 金属钠保存在煤油中 | ||
| C. | 氧化钠保存在敞口容器中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+I2(g)?2HI△H>0 | B. | N2+3H2?2NH3△H<0 | ||
| C. | 2SO3(g)?2SO2+O2△H>0 | D. | 4NH3+5O2(g)?4NO+6H2O(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
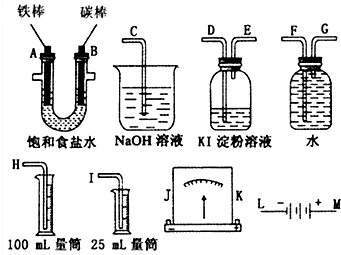 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
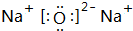 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
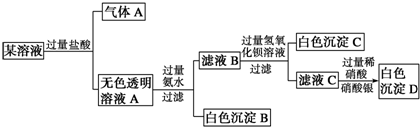
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com