
| A. | 氨气 | B. | 氮气 | C. | 一氧化氮 | D. | 硝酸 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
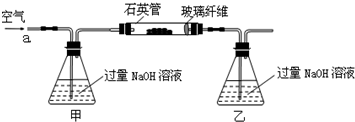

| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基(-CH3)含有9NA个电子 | |
| B. | 标准状况下,22.4LSO3含有的原子数为4NA | |
| C. | 0.10mol•L-1NaOH溶液中含有OH1离子数是0.1NA | |
| D. | 5.6Fe与2.24LCl2充分反应转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n | |
| B. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0 | |
| C. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b | |
| D. | 图Ⅱ可能是在同温同压下催化剂对反应的影响,且2表示使用催化剂后的反应过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电池放电时Li+向负极移动 | |
| B. | 电池放电时,正极的电极反应式为:2Li++Li2O2+2e-═2Li2O | |
| C. | 电池充电时,Li极应与外电源的正极相连 | |
| D. | 电池系统内进入二氧化碳及水对电池性能不会产生影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液 | |
| B. | c(OH-)=$\sqrt{{K}_{W}}$ | |
| C. | 由强酸与强碱等物质的量反应得到的溶液 | |
| D. | 强电解质溶于水得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为8.8g | B. | 物质的量为2mol | ||
| C. | 体积为4.48L | D. | 分子数目为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | b点酸的浓度小于a点酸的浓度 | |
| C. | b点溶液的导电性比c点溶液的导电性弱 | |
| D. | a点Kw的数值比c点Kw的数值小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com