
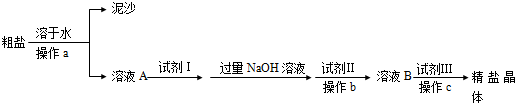


科目:高中化学 来源: 题型:
| A、乙烯的分子式:CH2═CH2 |
| B、次氯酸分子的结构式:H-O-Cl |
C、羟基的电子式: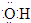 |
| D、以铁作阳极电解时,阳极的电极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 单质硼有无定形和晶体两种,参考下列数据.
单质硼有无定形和晶体两种,参考下列数据.| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点/K | 3823 | 1683 | 2573 |
| 沸点/K | 5100 | 2628 | 2823 |
| 硬度/Mob | 10 | 7.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
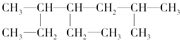
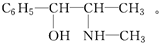
查看答案和解析>>
科目:高中化学 来源: 题型:
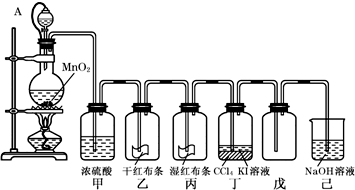
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
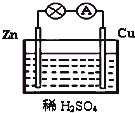 如图为原电池的示意图.请回答:
如图为原电池的示意图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com