
 上述方案是否合理?请简要说明两点理由。
上述方案是否合理?请简要说明两点理由。 科目:高中化学 来源: 题型:阅读理解

| 实验操作 | 预期现象与结论 |
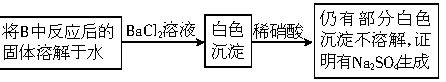
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 滴入1滴(或少量)品红 滴入1滴(或少量)品红 再滴入过量2mol/L盐酸,振荡 再滴入过量2mol/L盐酸,振荡 . |
若品红褪色(或有气泡),则“吸收液”中存在 SO32-. 若品红褪色(或有气泡),则“吸收液”中存在 SO32-. 若品红不褪色(或无有气泡),则“吸收液”中不存在 SO32- 若品红不褪色(或无有气泡),则“吸收液”中不存在 SO32- |
| 步骤3: 用试管取适量滤液 用试管取适量滤液 向其中滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 向其中滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 . |
若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-. 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-. 若不出现白色沉淀(或品红溶液不褪色,或没有气泡),则“吸收液”中不存在 HSO3-. 若不出现白色沉淀(或品红溶液不褪色,或没有气泡),则“吸收液”中不存在 HSO3-. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 预期现象与结论 | ||
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液. | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-. | ||
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中.往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入 2mol/L盐酸 2mol/L盐酸 . |
若加盐酸后出现气体,则证明溶液中存在SO32-. 若无气体,则不存在SO32-. 若加盐酸后出现气体,则证明溶液中存在SO32-. 若无气体,则不存在SO32-. | ||
| 步骤3: 在试管2中加入过量2mol/L盐酸,再滴入2滴品红,或:在试管2中加入过量lmol/L氢氧化钡溶液 在试管2中加入过量2mol/L盐酸,再滴入2滴品红,或:在试管2中加入过量lmol/L氢氧化钡溶液 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
- 3 |
2- 3 |
- 3 |
| 实验操作 | 预期现象与结论 | ||||
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在 SO
| ||||
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 |
|||||
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三12月调研考试化学试卷(解析版) 题型:实验题
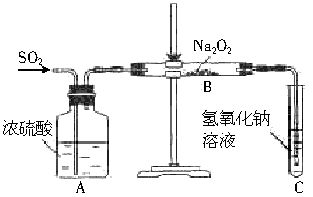
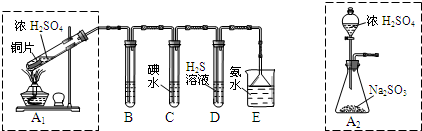
某兴趣小组设计如下图实验装置进行实验。

Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:

(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、
2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
|
实验操作 |
预期现象与结论 |
|
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则“吸收液” 中存在SO32-或 SO42-。 |
|
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 |
, 则“吸收液”中存在 SO32-。 |
|
步骤3: 。 |
, 则“吸收液”中存在 HSO3-。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com