
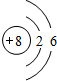 .
. ,该化合物分子内存在共价键,E的钠盐属于离子化合物.
,该化合物分子内存在共价键,E的钠盐属于离子化合物.分析 A、B、C、D、E为原子序数依次增大的短周期主族元素.A原子最外层电子数是次外电子数的二倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;B元素族序数是周期数的三倍,原子只能处于第二周期,处于VIA族,故B为O元素;C与A同主族,C的原子序数大于氧,故C为Si;D、E处于第三周期,而D元素原子次外层电子数比电外层电子数多3,其最外层电子数为5,故D为P元素,E是所在周期中原子半径最小的元素,则E为Cl,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的短周期主族元素.A原子最外层电子数是次外电子数的二倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;B元素族序数是周期数的三倍,原子只能处于第二周期,处于VIA族,故B为O元素;C与A同主族,C的原子序数大于氧,故C为Si;D、E处于第三周期,而D元素原子次外层电子数比电外层电子数多3,其最外层电子数为5,故D为P元素,E是所在周期中原子半径最小的元素,则E为Cl.
(1)D元素名称为:磷,B为O元素,原子结构示意图为: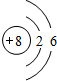 ,
,
故答案为:磷;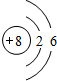 ;
;
(2)非金属性Cl>P>Si,故最高价氧化物对应水化物的酸性由强到弱的顺序为:HClO4>H3PO4>H2SiO3,
故答案为:HClO4>H3PO4>H2SiO3;
(3)O、Cl及氢三种元素可组成的一种具有漂白性的简单化合物为HClO,该化合物电子式为 ,该化合物分子内存在共价键,E的钠盐为NaCl,属于离子化合物,
,该化合物分子内存在共价键,E的钠盐为NaCl,属于离子化合物,
故答案为: ;共价;离子;
;共价;离子;
(4)a.元素A的单质在空气中燃烧会产生二氧化碳,二氧化碳会导致“温室效应”,故a走着去;
b.Si单质可以用作将太阳能转变成电能的光电池材料,故b正确;
c.氯水具有强氧化性,具有漂白性,不能应可用干燥的pH试纸检验氯水溶液的pH,故c错误;
d.白磷在空气中易被氧化自燃,故d正确;
e.B与A形成的C0、二氧化碳属于分子晶体,B与C形成的化合物为二氧化硅,属于原子晶体,沸点较高,故e错误,
故选:ce.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(4)中c选项为易错点,学生溶液考虑溶液酸性,而忽略漂白性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | AxBy | |
| 甲 | 8g | 4g | 11g |
| 乙 | 7g | 5g | 11g |
| A. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO | B. | Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$ FeS | ||
| C. | 3Fe+2O2$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4 | D. | 2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 盐 | 电解质 | 碱性氧化物 | |
| A | 氯水 | 蔗糖 | 纯碱 | NaHCO3 | 氧化铝 |
| B | 稀硫酸 | 水玻璃 | 小苏打 | NH3•H2O | 氧化镁 |
| C | 冰 | 王水 | 苏打 | H2SiO3 | 过氧化钠 |
| D | 乙醇 | 碘化银胶体 | 碱式碳酸铜 | NaOH | 氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 稀硫酸滴入含酚酞的Ba(OH)2溶液中 | 白色沉淀生成,溶液由红色变无色 | Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |
| B | 磁性氧化铁(Fe3O4)溶于氢碘酸 | 磁性氧化铁溶解,溶液变棕黄色 | Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C | Ca(OH)2澄清溶液加到氯水中 | 溶液由黄绿色变为无色 | Cl2+2Ca(OH)2═Cl-+ClO-+Ca2++H2O |
| D | 稀硫酸加到KI淀粉溶液中 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | H2(g)+12O2(g)═H2O(g)△H=-285.8kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用以下反应制取氮气:NaNO2+NH4Cl$\underset{\stackrel{65℃}{=}}{△}$NaCl+N2↑+2H20,已知氮化镁易与水反应,Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓在设计装置时必须考虑这一点:
用以下反应制取氮气:NaNO2+NH4Cl$\underset{\stackrel{65℃}{=}}{△}$NaCl+N2↑+2H20,已知氮化镁易与水反应,Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓在设计装置时必须考虑这一点:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com