
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
分析 盛有N2和NO2的混合气体的试管倒立于水中发生3NO2+H2O=2HNO3+NO,利用反应的化学方程式进行计算.
解答 解:设原混合气体中含有xmolN2,ymolNO2,
盛有N2和NO2 的混合气体的试管倒立于水中发生3NO2+H2O=2HNO3+NO,则
3NO2+H2O=2HNO3+NO
3 1
y $\frac{y}{3}$
则(x+$\frac{y}{3}$):(x+y)=1:2,
解得x:y=1:3,
故选C.
点评 本题考查混合物的计算,题目难度不大,本题注意利用物质的性质,根据反应的化学方程式计算,体积变化的原因是由于NO2与水反应的缘故,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
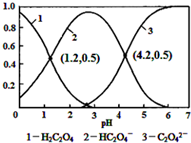
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×c(C2O42-)=1000 | |
| C. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2 | |
| D. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
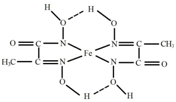 铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.它的单质及化合物在科学研究和工业生产中具有许多用途.根据所学知识回答下列问题:
铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.它的单质及化合物在科学研究和工业生产中具有许多用途.根据所学知识回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |

| A. | 该电池的正极反应式为MnO2+eˉ+H+═MnOOH | |
| B. | 利用干电池,高温电解H2O-CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1 | |
| C. | 废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离 | |
| D. | 废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com