
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 ( )。

A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.某烷烃的名称为2,2,4,4 -四甲基-3,3,5-三乙基己烷
B.乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别
C.化合物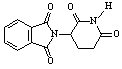 在酸性条件下水解,所得溶液加碱加热后有NH3生成
在酸性条件下水解,所得溶液加碱加热后有NH3生成
D.桶烯(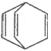 )与苯乙烯
)与苯乙烯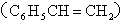 互为同分异构体,均属于芳香烃
互为同分异构体,均属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
海水
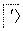


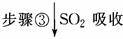



(1)步骤③的离子方程式:_________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:________________________________________________。
(5)步骤①中用硫酸酸化可提高Cl2的利用率,理由是___________ __________________________________________________________。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列不发生反应的一组物质是 ( )。
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸 ④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸
A.①②④ B.③④⑥
C.②⑤⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是________。
A.陶瓷 B.玻璃
C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为________________________,工艺师常用________(填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作________。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)工业上常利用反应2C+SiO2 Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2.8 g Fe全部溶于一定浓度、200 mL 的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是 ( )。
A.反应后溶液中c(NO )=0.80 mol·L-1
)=0.80 mol·L-1
B.反应后的溶液最多还能溶解1.82 g Fe
C.反应前HNO3溶液的浓度为1.0 mol·L-1
D.1.12 L气体是NO、NO2的混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是 ( )。
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Cu都是用热还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
将几滴KSCN(SCN-是“类卤离子”)溶液加入到硫酸酸化的硫酸铁溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。以下推测肯定不正确的是 ( )。
A.①中红色褪去的原因是KMnO4将SCN-氧化
B.②中红色褪去的原因是SO2将Fe3+还原成Fe2+
C.②中红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为SO2+2Fe3++2H2O===SO +2Fe2++4W ①,Cr2O
+2Fe2++4W ①,Cr2O +aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
+aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
A.还原性:Cr3+>SO2
B.方程式②中,a=6,b=7
C.Cr2O 能将Na2SO3氧化成Na2SO4
能将Na2SO3氧化成Na2SO4
D.方程式①中W为OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com