
| | A | B | C | D |
| 碱 性 | AOH>BOH | AOH>BOH | AOH<BOH | AOH<BOH |
| 酸 性 | HC<HD | HC>HD | HC>HD | HC< HD |
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:不详 题型:问答题
| 催化剂 |
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(OH-) | B.pH | C.c(NH4+)/c(NH3·H2O) | D.c(H+)·c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
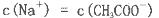
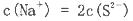
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol/L HX溶液的pH值约为2 |
| B.HX能与水以任意比例互溶 |
| C.10 mL 1mol/L HX恰好与10 mL l mol/L NaOH溶液完全反应 |
| D.HX溶液的导电性比强酸溶液的弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.当pH=2时,溶液中c(ClO-)>c(Na+) |
| B.当c(ClO-)>c(HClO)时,溶液一定呈碱性 |
| C.当pH=3.45时,所加NaOH溶液恰好与HClO完全反应 |
| D.当pH=5时,溶液中:c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0. 1mol/L (NH4)2SO4溶液中:c(SO42—)<c(NH4+) |
| B.相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH—)之比是2:1 |
| C.向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3—) |
| D.常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO—) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
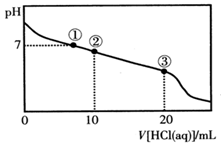
| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
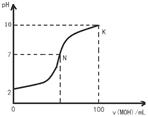
| A.MOH是弱碱 |
| B.N点c(Cl-) = c(M+) |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com