
����Ŀ��SO2��NOx���Ǵ�����Ⱦ�
��1�������ŷŵ�β���к�CO��NO����������������ʱ������NO��CO��ͨ����ת����ת��Ϊ��������Ⱦ�����壬�÷�Ӧ�Ļ�ѧ����ʽ��
��2����ȡ��ԭ������̿�ۿɽ��������ﻹԭ��
��֪��N2��g��+O2��g���T2NO��g����H=+180.6kJmol��1��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��ӦC��s��+2NO��g���TCO2��g��+N2��g����H=kJmol��1 ��
��3����NO2�������N2Ҫ�ҵ��ʺϵ�����G���ʵ��ķ�Ӧ������GӦΪ����д������������ԭ����������ʽ��X����Ϊ����Ⱦ�����ʣ�ϵ��n����Ϊ0��NO2+G ![]() N2+H2O+nX ��δ��ƽ�ķ�Ӧʽ����
N2+H2O+nX ��δ��ƽ�ķ�Ӧʽ����
���л������У�����������Ӧʽ�е�G������д��ĸ����
a��NH3b��CO2c��SO2d��CH3CH2OH
��4�����ð�ˮ���Խ�SO2��NO2���գ�ԭ����ͼ1��ʾ��NO2�����յ����ӷ���ʽ�� 
��5������ͼ2��ʾװ�ã��缫��Ϊ���Ե缫��Ҳ������SO2 �� ���������ų�����Һ����NO2 �� 
��b���ĵ缫��ӦʽΪ��
���ڼ��������£��������ų�����Һ����NO2 �� ʹ��ת��Ϊ�����壬ͬʱ��SO32�����ɣ��÷�Ӧ���ӷ���ʽΪ ��
���𰸡�
��1��2CO+2NO ![]() 2CO2+N2
2CO2+N2
��2����574.1
��3����ԭ����ad
��4��2NO2+4HSO3��=N2+4SO42��+4H+
��5��2HSO3��+2H++2e��=S2O42��+2H2O��4S2O42��+2NO2+8OH���T8SO42��+N2+4H2O
���������⣺��1��CO��NO2ͨ����ת��������ת��Ϊ����Ⱦ�����������ǵ����Ͷ�����̼����ӦΪ2CO+2NO ![]() 2CO2+N2 ��
2CO2+N2 ��
���Դ��ǣ�2CO+2NO ![]() 2CO2+N2��
2CO2+N2��
��2.�����ݸ�˹���ɣ�һ����Ӧ������һ����ɻ��Ƿ�Ϊ������ɣ�����ЧӦ����ͬ�ģ���֪��
N2��g��+O2��g��=2NO��g����H=+180.6kJmol��1 ��
C��s��+O2��g��=CO2��g����H=��393.5kJmol��1 ��
���ک��ٿɵã�C��s��+2NO��g��=CO2��g��+N2��g����H=��393.5kJmol��1��180.6kJmol��1=��574.1KJ/mol��
���Դ��ǣ���574.1��
��3.����NO2�������N2�У���Ԫ�صĻ��ϼ۽����ˣ���������������������Ҫ���뻹ԭ�����������������ʣ�a��NH3 b��CO2 c��SO2 d��CH3CH2OH�У��ܱ����������������л�ԭ�Ե��������Ҵ���NH3 ��
���Դ��ǣ���ԭ����ad��
��4.����ˮ���Խ�SO2��NO2ͬʱ���մ��������������백ˮ��Ӧ����������������ӣ�NO2�����յ����ӷ���ʽ��2NO2+4HSO3��=N2+4SO42��+4H+ ��
���Դ��ǣ�2NO2+4HSO3��=N2+4SO42��+4H+ ��
��5.��������ͼʾ��֪��������HSO3���õ�������S2O42�� �� ������������Ӧ2HSO3��+2H++2e��=S2O42��+2H2O��
���Դ��ǣ�2HSO3��+2H++2e��=S2O42��+2H2O��
�������ų�����ҺΪS2O42�� �� �����������䷢����Ӧ��S2O42������Ԫ����+3�ۣ���Ϊ���������Ԫ��Ϊ+4�ۣ�S2O42���������ǻ�ԭ�������������еĵ�Ԫ�ػ��ϼ�Ϊ+4�۱�Ϊ����0�ۣ�������������ԭΪ������������ԭ���غ�͵�ʧ�����غ�ɵã����������ӷ���ʽΪ4S2O42��+2NO2+8OH���T8SO42��+N2+4H2O��
���Դ��ǣ�4S2O42��+2NO2+8OH���T8SO42��+N2+4H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.0.1mol/LCH3COOH��Һ��ˮϡ�ͣ���Һ��c��OH��������
B.��NaOH�Ͱ�ˮ��Һ��ϡ��һ�������ߵ�OH��Ũ�Ⱦ����ٵ�ԭ���� ![]()
C.��ͬŨ�ȵ�HCl��CH3COOH������Һ��c��H+����ͬ
D.����Һ��pH��5������Һ��pH��4�������Һ������Һ����c��H+��֮��Ϊ10��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧϰС�������һϵ�л�ѧʵ����ָ�����طֽ��ĺ���Ԫ�صĻ����ﶼ�ܺ�Ũ���ᷴӦ�Ƶ����������̻�����Ļ�ԭ���ﶼ��MnCl2 �� ���ǽ�6.32gKMnO4��ĩ����һ��ʱ�䣬Ҳ��֪����������Ƿ���ȫ�ֽ⣬�ռ���0.112L������ֹͣ�����ˣ���ȴ�����������Ũ�����ټ��ȣ����ռ�����������ǣ���������������ۺϳɱ�״������ ��
A.0.448L
B.2.240L
C.2.016L
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(˫ѡ��)����Al2O3����˵����ȷ����( )
A��Al2O3����ͨ���ֽⷴӦ�ͻ��Ϸ�Ӧ�Ƶ�
B��Al2O3������������
C��Al2O3��Ĥ�dz����ܣ����Կ�����������ʢ��HCl��Һ��NaOH��Һ��
D����ȥ�������������������ھƾ���������ʱ���ۻ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����[Ce2��CO3��3]Ϊ��ɫ��ĩ��������ˮ����Ҫ������������м仯��������ɷ�̼���澫����ͼ1�����Ƶã� 
��1����ͼ2��һ��ϡ��Ԫ���棨Ce����Ԫ�����ڱ��е���Ϣʾ��ͼ������ԭ�ӵ��������� �� ��̼����Ļ�ѧʽΪCeFCO3 �� �û������У�Ce�Ļ��ϼ�Ϊ��
��2���������ɵ��滯����Ϊ�������棨CeO2�����������ʱ������Ӧ�����ӷ���ʽΪ��
��3���Լ�X��
��4����֪298Kʱ��Ksp[Ce��OH��4]=1��10��29 �� Ce��OH��4���ܶȻ�����ʽΪKsp=��Ϊ��ʹ��Һ��Ce4+������ȫ�������pHΪ���ϣ�
��5��ȡijCe��OH��4��Ʒ1.00g����������Ϊ97%�����������ܽ����0.1000molL��1��FeSO4��Һ�ζ����յ㣨�汻��ԭ��Ce3+������Ҫ�μӱ���Һ�����mL�����������ữ�����0.1000molL��1��FeCl2��Һ�ζ���Ʒ�Ӷ��ⶨCe��OH��4��Ʒ������������������������ȷ����ⶨ��Ce��OH��4��Ʒ�������������ƫ�ߡ�����ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.1 mol/L��AlCl3��Һ��0.1 mol/L������������Һ�����������ʵ�顣
���Թ���ʢ������AlCl3��Һ10 mL����������ε���������NaOH��Һ��
(1)����10 mL NaOH��Һʱ��������________������30 mL NaOH��Һʱ��������________������35 mL NaOH��Һʱ��������____________________��
(2)���ɳ����������ʱ����NaOH��Һ________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��֪HClO�DZ�H2CO3�������ᣬHClO�ĵ���ƽ�ⳣ��Ϊ2.95��10-5��H2CO3�ĵ���ƽ�ⳣ��ΪK1��4.3��10��7��K2��5.6��10��11��ˮ�д�������ƽ�⣺Cl2��H2O![]() HCl��HClO��HClO
HCl��HClO��HClO![]() H����ClO������ƽ���
H����ClO������ƽ���
(1)ҪʹHClOŨ�����ӣ��ɼ�����������________(�����)��
A��SO2 B��NaHCO3 C��HCl D��NaOH
(2)�ɴ�˵����ʵ���ҿ����ű���ʳ��ˮ�ռ�Cl2��������________________��
��.Al(OH)3�ĵ��뷽��ʽ�ɱ�ʾΪ��H2O��AlO2����H��![]() Al(OH)3
Al(OH)3![]() Al3����3OH����
Al3����3OH����
�Ը���ƽ���ƶ�ԭ�������������й����⡣
(1)��Al(OH)3�����м������ᣬ�����ܽ⣬��ԭ����_________________���й����ӷ���ʽΪ__________________��
(2)��Al(OH)3�����м����������Һ�������ܽ⣬��ԭ����________________���й����ӷ���ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ��ʳ��ֲ�Ϊ����֤�����ݷ���Һ���е���ø��ijѧ�����������ʵ�飬����ͼ��ʾ����35��ˮԡ����һ��ʱ���1��2������������˫�����Լ���3��4�������κ��Լ���������������ȷ���� �� ��
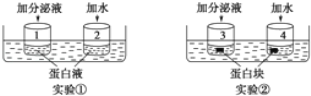
A��ʵ��١�ʵ��ڵ��Ա������������ݷ���Һ
B��ʵ��ٵ�������۲�ָ��Ϊ��Һ��ɫ��ʵ�����������۲�ָ��Ϊ�������
C��ʵ��١�ʵ��ھ��ﵽʵ��Ŀ��
D���������ʵ���¶ȣ����ܻ�Ӱ��ʵ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com