
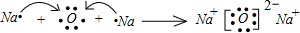 ,
,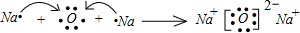 ;
;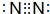 ,结构式为:N≡N,故答案为:
,结构式为:N≡N,故答案为: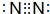 ;N≡N;
;N≡N; ,故答案为:
,故答案为: ;
;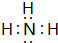 ,N、H元素之间形成极性键,属于三角锥形,分子中正负电荷中心不重合,属于极性分子,且水溶液呈碱性,故答案为:
,N、H元素之间形成极性键,属于三角锥形,分子中正负电荷中心不重合,属于极性分子,且水溶液呈碱性,故答案为: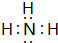 ;极性;极性;碱;
;极性;极性;碱;

科目:高中化学 来源: 题型:

| NaCN |
| H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、在x点,ROH未完全电离 |
| B、在x点,c(M+)>c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、pH=2的盐酸与pH=12的MOH等体积混合后,溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D四种物质的转化关系如图所示(反应条件及其产物乙略去),请回答下列问题:
A、B、C、D四种物质的转化关系如图所示(反应条件及其产物乙略去),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
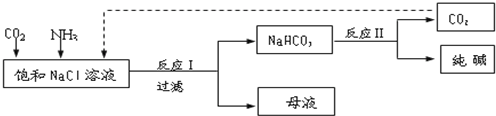
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com