
【题目】物质A~K存在下图转化关系,其中气体D为单质,E为氯气。试回答下列问题:

(1)写出下列物质的化学式:A是________。
(2)写出下列反应的离子方程式:
C→F____________________________________________
I→J_____________________________________________
(3)在溶液I中滴入NaOH溶液,可观察到的现象是___________________________,其反应的原理为____________________________________(写化学方程式)。
(4)检验溶液J中的金属阳离子,所选用的试剂为__________(填化学式),现象为___________________。
【答案】Al Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Fe2++Cl2=2Fe3++2Cl- 先生成白色絮状沉淀,然后迅速变为灰绿色,最后变成红褐色 FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3 KSCN 出现血红色
【解析】
红褐色沉淀为氢氧化铁,说明溶液J 中含有铁离子,气体E为氯气,说明溶液I 中含有亚铁离子,单质气体D和氯气反应生成气体B ,说明D为氢气,B为氯化氢。溶液C和氨水反应生成白色沉淀,溶于氢氧化钠,说明该白色沉淀为氢氧化铝,则金属A为铝。
(1) 溶液C和氨水反应生成白色沉淀,溶于氢氧化钠,说明该白色沉淀为氢氧化铝,则金属A为铝;
(2)氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵,离子方程式为: Al3++3NH3·H2O=Al(OH)3↓+3NH4+ ;
氯化亚铁和氯气反应生成氯化铁,离子方程式为: 2Fe2++Cl2=2Fe3++2Cl- ;
(3).氯化亚铁溶液中加入氢氧化钠溶液,反应生成氢氧化亚铁沉淀现象为:先生成白色絮状沉淀,然后迅速变为灰绿色,最后变成红褐色;方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;
(4) 检验溶液J中的金属阳离子为铁离子,用KSCN检验,现象为出现血红色。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上可利用如图所示电解装置吸收和转化![]() (A,B均为惰性电极)。下列说法正确的是( )
(A,B均为惰性电极)。下列说法正确的是( )
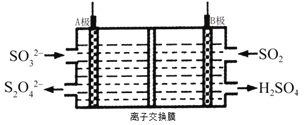
A. B电极为电解池的阴极
B. B极区吸收5mo1 ![]() ,则A极区生成2.5mo1
,则A极区生成2.5mo1 ![]()
C. B极区电解液为稀硫酸,电解一段时间后硫酸浓度增大
D. A电极的电极反应为: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
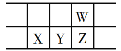
A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B. 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA
C. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 金属钠着火时使用泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )
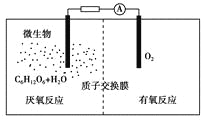
A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中:K+、NH4+、Cl-、SO42-
B.室温下,能使紫色石蕊溶液变红的溶液中:Na+、Fe3+、NO3-、SO42-
C.含有0.1 mol/L Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.在无色透明的溶液中:K+、Cu2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
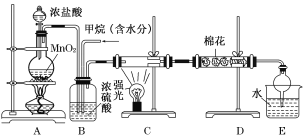
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:______________________________。
有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或 “不正确”)。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A.分液法 B.蒸馏法 C.结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为 ,生成HCl的物质的量共为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )

A. 原溶液中一定含有SO42-B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl-D. 原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知A是原子结构最简单的元素;B元素原子最外层上的电子数是其电子层数的2倍;A和C之间可形成A2C和A2C2两种化合物;D在同周期主族元素中原子半径最大,请回答下列问题。
(1)C元素在元素周期表中的位置是____________;C、D两种元素所形成的简单离子,离子半径由大到小的顺序是________________。(用离子符号表示)
(2)写出A2C2的电子式__________。
(3)在恒温下,体积为2 L的恒容容器中加入一定量的B单质和1 mol A2C蒸汽,发生:B(s)+A2C(g) BC(g)+A2(g)。2 min后,容器的压强增加了20%,则2 min内A2C的反应速率为________。一段时间后达到平衡,下列说法正确的是__________。
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2 min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在DCA溶液中可形成一种燃料电池。该电池的负极反应式为:___________。
(5)将0.2 mol D2C2投入到含有0.1 mol FeCl2的水溶液中恰好充分反应,反应的总化学方程式为:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com