
| A、铁粉与稀盐酸反应Fe+2H+=Fe3++H2↑ |
| B、少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
| C、氧化铜溶于硫酸:O2-+2H+=H2O |
| D、碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |


科目:高中化学 来源: 题型:
| A、①②③④⑤⑥⑦ | B、①④⑥⑦ |
| C、① | D、①④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、醋酸溶液除水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ |
| D、向NaAlO2溶液中滴加NaHCO3溶液HCO3-+AlO2-+H2O=A(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
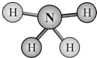 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )
肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )| A、肼分子中的氮原子采用sp3杂化 |
| B、肼分子中既有极性键又有非极性键 |
| C、肼分子是非极性分子 |
| D、肼与偏二甲肼互称同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乳浊液 | B、溶液 |
| C、胶体 | D、悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
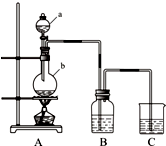 利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.据此回答:
利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解;然后将所得溶液分置 于A、B试管中. | 溶液呈黄绿色,说明溶液中含Fe2+或Fe3+. |
| 步骤2: | |
| 步骤3: | |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
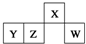 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A、原子半径:rW>rZ>rY>rX |
| B、含Y元素的硫酸盐溶液可以和强酸、强碱反应 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X与氢元素组成的化合物XH5与水反应可产生两种气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com