
【题目】关于下列各图像的说法中正确的是
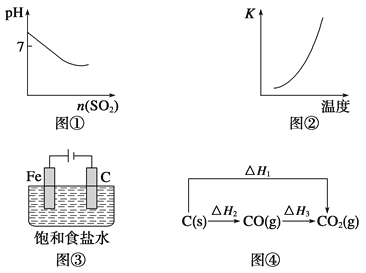
A.图①表示将SO2气体通入溴水中
B.图②表示反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的平衡常数K随温度的变化
2NH3(g) ΔH<0的平衡常数K随温度的变化
C.图③中阴、阳两极收集到的气体体积之比一定为1∶1
D.图④中的ΔH1<ΔH2
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g)△H <0,下列说法正确的( )
2AB2(g)△H <0,下列说法正确的( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠与工农业生产、日常生活紧密相关。工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:方案一:沉淀分析法(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀_______(填操作)、洗涤、烘干、称量,洗涤沉淀的操作是____________________。方案二:气体分析法(2)把一定量的样品与足量盐酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用______________________,但选用该溶液后实验结果仍然不够准确,其原因是___________________。
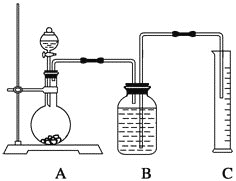
方案三:质量差分析法(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差求算样品的纯度。

该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g;②取n g样品装入广口瓶中;③检验装置的气密性;④缓慢鼓入空气数分钟,再称量干燥管质量为w g;⑤关闭止水夹;⑥打开止水夹;⑦缓慢加入稀硫酸至不再产生气体为止;⑧缓慢鼓入空气数分钟。Ⅰ.正确的操作顺序是(填序号):③→__________→⑥→________→⑤→________→⑦→_______→④。Ⅱ.若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]化合物M是一种香料,A与D是常见的有机化工原料,按下列路线合成化合物M: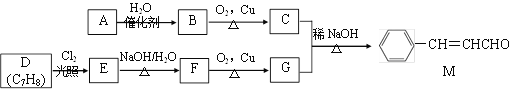
已知以下信息:
①A的相对分子质量为28
回答下列问题:
(1)A的名称是___________,D的结构简式是___________。
(2)A生成B的反应类型为________,C中官能团名称为___________。
(3)E生成F的的化学方程式为___________。
(4)下列关于G的说法正确的是___________。(填标号)
a.属于芳香烃
b.可与FeCl3溶液反应显紫色
c.可与新制的Cu(OH)2共热生成红色沉淀
d.G分子中最多有14个原子共平面
(5)化合物M的同系物N比M的相对分子质量大14,N的同分异构体中同时满足下列条件的共有________种(不考虑立体异构)。
①与化合物M含有相同的官能团;②苯环上有两个取代基
(6)参照上述合成路线,化合物X与Y以物质的量之比2:1反应可得到化合物 ,X的结构简式为________,Y的结构简式为________。
,X的结构简式为________,Y的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
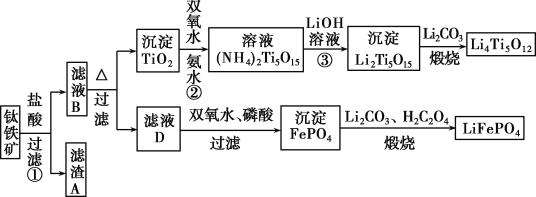
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl![]() +2H2O。
+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应方程式是_________________。
(3)滤液B中TiOCl![]() 转化生成TiO2的离子方程式是____________________。
转化生成TiO2的离子方程式是____________________。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是__________ ____。
(5)由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是 (填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
上表中的温度差平均值为 ℃
近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③ 上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com