
【题目】钛被称为继铁、铝之后的第三金属。工业上常用硫酸酸解钛铁矿(主要成分为FeTiO3,还含有部分Fe2O3)的方法制取金红石(TiO2),再还原TiO2制取金属钛。工业制取TiO2的工艺流程图如下:

回答下列问题:
(1)钛酸亚铁(FeTiO3)中Ti的化合价为________________________。
(2)钛液1中钛以TiO2+的形式存在,则FeTiO3与硫酸反应的离子方程式为________。
(3)为提高钛铁矿的酸解率,可添加适量氧化剂,依据右图判断,添加的最佳氧化剂为_____________(填化学式)。

(4)钛液1中加入的A物质是____________,流程中的操作a是____________。
(5)制取金红石过程中,需要测定TiO2+的含量。取100mL钛液1,加铝粉,使其发生反应3TiO2++Al+6H+=3Ti3++Al3++3H2O,反应消耗铝1.35g,则钛液1中TiO2+的物质的量浓度为________。
【答案】+4价 FeTiO3+4H+=TiO2++Fe2++2H2O KMnO4 铁粉或铁 洗涤、干燥 1.5mol/L
【解析】
本题主要考查制备实验方案的设计。
钛铁矿和硫酸混合,钛铁矿和硫酸反应的产物之一是TiOSO4,钛铁矿中含有Fe2O3,故反应后的钛液1中含有Fe3+,故需向钛液1中加入铁屑,发生反应2Fe3++Fe=3Fe2+,反应后溶液中溶质为TiOSO4和FeSO4,再将溶液冷却结晶、过滤得到绿矾和钛液2,钛液2中含有TiOSO4,先将钛液2中加入沸水,TiO2+水解生成H2TiO3,然后过滤回收硫酸,同时将固体干燥得到H2TiO3,再经过煅烧得到TiO2,据此分析解答。
(1)钛酸亚铁(FeTiO3)中Fe为+2价,O为-2价,根据化合物中各元素化合价代数和为0可知,Ti为+4价;
(2)由上述分析可知,FeTiO3与硫酸反应的离子方程式为:FeTiO3+4H+=TiO2++Fe2++2H2O;
(3)由图分析可知,最佳氧化剂为KMnO4;
(4)钛液1中含有Fe3+,故需向钛液1中加入铁屑,将Fe3+还原;操作a的目的是得到较纯的H2TiO3固体,故操作a是洗涤、干燥;
(5)由3TiO2++Al+6H+=3Ti3++Al3++3H2O可知,每消耗1molAl的同时,会消耗3molTiO2+,100mL钛液1消耗0.05molAl,即100mL钛液1中含有0.15molTiO2+,故钛液1中TiO2+的物质的量浓度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种除去杂质的方案:
①除去乙烷中的少量乙烯,催化剂条件下通入氢气;②除去CO2中的少量CO,气体通过灼热的CuO;③除去CO2中的少量SO2,气体通过盛有饱和Na2CO3溶液的洗气瓶;④除去乙醇中的少量乙酸,加入足量的生石灰,蒸馏,馏分是乙醇。
在实验室中,上述方案可行的是______(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.两种难溶盐电解质,其中Ksp小的溶解度一定小
B.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀
C.难溶盐电解质的Ksp与温度有关
D.同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用固体NaOH配制一定物质的量浓度的溶液时,下列操作会导致溶液浓度偏高的是
A.在烧杯中溶解时,有少量液体溅出B.样品中含有少量Na2O杂质
C.容量瓶使用前未干D.定容时仰视液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g![]() 的变化如右图所示。下列说法正确的是
的变化如右图所示。下列说法正确的是
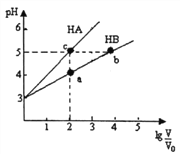
A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是常用的催化剂、氧化剂和活性电极材料。海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:

已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰。下列推断不正确的是( )
A.反应Ⅰ的离子方程式为MnO2+H2O2+2H+===Mn2++2H2O+O2↑
B.反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O===MnO2↓+4H+
C.若加入KClO3,则反应Ⅲ为2ClO+5Mn2++4H2O===5MnO2↓+Cl2↑+8H+
D.若加入KMnO4,则反应Ⅲ为3Mn2++2MnO+2H2O===5MnO2↓+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com