


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 1、实验室要配制物质的量浓度为0.1mol/L的NaOH溶液480mL
1、实验室要配制物质的量浓度为0.1mol/L的NaOH溶液480mL| 配制时应称量 NaOH的质量/g |
已给仪器 | 配制时除已给仪器外 还需要的其他仪器 |
2.0 2.0 |
烧杯、药匙、 托盘天平 |
500mL容量瓶、玻璃棒、胶头滴管 500mL容量瓶、玻璃棒、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
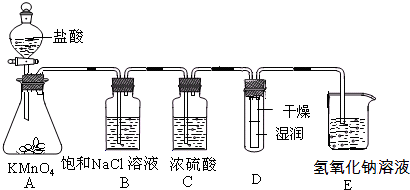
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期九月份月考化学试卷(必修1第1-3章部分内容) 题型:填空题
(16分)(1)配制物质的量浓度为0.2 mol/L的NaOH溶液500 mL,填空并请回答下列问题:
|
应称量NaOH的质量/g |
已给仪器 |
除已给仪器外还需要的其他仪器 |
|
|
烧杯、药匙、 托盘天平 |
|
(1)
(2)下列操作对配制的NaOH溶液浓度有偏高影响的是_______
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
(3)当向0.2 mol/L NaOH的溶液通入一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①______ _,② , ③______ __, ④ 。
(4)向0.1 mol/L的AlCl3溶液中加入过量的0.2 mol/L的NaOH溶液,则发生反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com