
| A. | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O | |
| B. | 2NO2+2OH-=NO3-+NO2-+H2O | |
| C. | SnCl4+2H2O=SnO2+4HCl | |
| D. | CO32-+CO2+H2O=2HCO3- |
分析 氧化还原反应的实质为电子转移、特征为化合价升降,所以氧化还原反应中一定存在元素化合价变化,据此对各选项进行判断.
解答 解:A.2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O,反应中不存在化合价变化,不属于氧化还原反应,故A错误;
B.反应2NO2+2OH-=NO3-+NO2-+H2O,N元素的化合价发生变化,属于氧化还原反应,故B正确;
C.SnCl4+2H2O=SnO2+4HCl,反应中不存在化合价变化,不属于氧化还原反应,故C错误;
D.CO32-+CO2+H2O=2HCO3-,不存在化合价变化,不属于氧化还原反应,故D错误;
故选B.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握四种基本反应类型与氧化还原反应之间的关系,试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
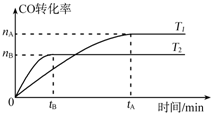 乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.
乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳通过Na2O2粉末后固体物质质量增加 | |
| B. | 在NaClO溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| C. | Na2S溶液在空气中长期放置变浑浊的离子方程式为2S2-+O2+4H+=2S↓+2H2O | |
| D. | NH4HCO3溶液中滴加足量NaOH溶液的离子方程式为HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应---二氧化碳 | B. | 光化学烟雾---二氧化氮 | ||
| C. | 酸雨---二氧化碳 | D. | 臭氧层破坏---氟氯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,金属银的表面生成一层黑色物质 | |
| B. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
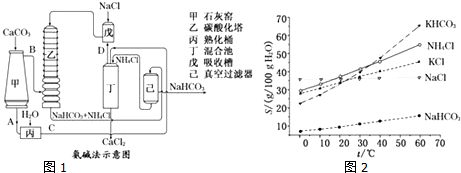
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com