
(1)利用反应6NO2+8NH3 ![]() 7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2)物质A~E都是中学化学中常见的物质,它们可发生如图所表示的反应:
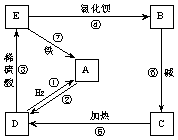
在以上反应中(用序号填空):属于氧化还原反应的是 ;属于复分解反应的是 。反应③的离子方程式为 :
若以反应⑦设计一个原电池,则原电池的负极材料应为 。
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
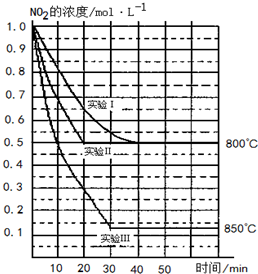 某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)
某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)| c(NO)2×c(O2) |
| c(NO2)2 |
| c(NO)2×c(O2) |
| c(NO2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2 | O2 | Ar | CO2 |
| -196℃ | -183℃ | -186℃ | -78℃ |
| ||

查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省长沙市高三第四次月考化学试卷(解析版) 题型:填空题
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:
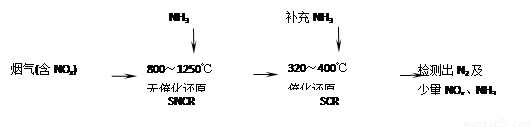
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
①4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ•mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ•mol-1;
②6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ•mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ•mol-1;
③6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ•mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ•mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH=
kJ•mol-1。
2NO(g)的ΔH=
kJ•mol-1。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。

该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为:
(4)可利用该电池处理工业废水中含有的Cr2O72-,处理过程中用Fe作两极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀来除去Cr2O72-。
①写出电解过程中Cr2O72-被还原为Cr3+的离子方程式: 。
②该电池工作时每处理100L Cr2O72-浓度为0.002mol/L废水,消耗标准状况下氧气 L。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市高三第三次模拟化学试卷(解析版) 题型:计算题
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:

氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2)氧化时控制反应液温度为55~60℃的原因是 。
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg 乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com