
【题目】甲酸(HCOOH)是一种常见的一元弱酸,在水溶液中存在如下电离平衡:HCOOH![]() H++HCOO-,下列有关说法不正确的是
H++HCOO-,下列有关说法不正确的是
A.在该溶液中,c(H+)略大于c(HCOO-)
B.向该溶液中加入NaOH固体,电离平衡正向移动,pH值增大
C.将氯化氢气体通入溶液中,平衡逆向移动,c(HCOO-)增大
D.将溶液加水稀释,c(OH-)增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源(锌铜硫酸原电池)使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A.铜片为负极B.锌片上发生还原反应
C.其能量转化的形式主要是“化学能→电能→光能”D.如果将稀硫酸换成盐酸,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
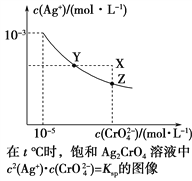
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取粗碘的某种工艺流程如图所示(部分操作名称已省略)。
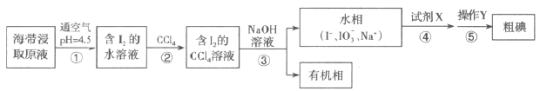
下列有关说法错误的是( )
A.步骤②的操作是萃取
B.步骤③的NaOH是还原剂
C.步骤④的试剂X是稀硫酸
D.步骤⑤的操作Y是过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol甲基中含有电子数为10NA
B. 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA
C. 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA
D. 50mL12mol·L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的化工原料之一,自20世纪初以来,工业上合成氨主要依赖Haber-Bosch技术。探索新的合成氨的方法一直是重要课题。
(1)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气。
已知:N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
写出上述固氮反应的热化学方程式:_______________。
(2)恒温、恒容条件下,在容器中模拟Haber-Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
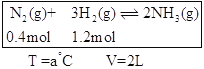
①判断该容器中的反应达平衡的依据是_______(填字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(N2)不随时间改变
d.单位时间内生成2 mol NH3的同时消耗1 mol N2
e.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=___;平衡时,混合气体压强p平=____(用初始压强p0表示)。
(3)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如图:
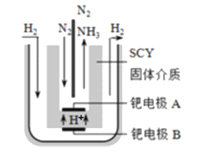
钯电极A是电解池的_____极(填“阳”或“阴”),阴极反应式为________________________________。
(4)合成氨需要纯净的氮气和氢气,在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨的催化剂“中毒”,所以必须除去。例如,用稀氨水吸收H2S杂质:NH3·H2O + H2S![]()
![]() +HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
+HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确且解释合理的是
说法 | 解释 | |
A | 一定温度压强下,2 g H2 和 4 g H2 完全燃烧,后者 燃烧热的数值大 | 4 g H2 放出热量多 |
B | 2SO2(g)+O2(g) 平衡后再加入 SO2,Q 增大 | 平衡右移,放出热量增多 |
C | 向等物质的量浓度的 NaI 和 KBr 混合液中滴加 AgNO3 溶液,先生成黄色 AgI 沉淀 | Ksp(AgI)<Ksp(AgBr) |
D | 等物质的量浓度 Na2CO3 的 pH 大于 CH3COONa | H2CO3 的酸性比 CH3COOH 强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
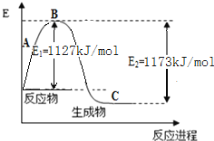
【题目】(1)实验测得5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:___________________________。
(2)现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意如图。根据下列已知键能数据计算N-H键键能为____________________kJ/mol 。
化学键 | H-H |
|
键能(kJ/mol) | 436 | 946 |
(3)用如图所示装置进行中和热测定实验,请回答下列问题:
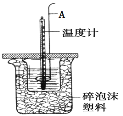
仪器A的名称为 ________________________ 。
取30mLH2SO4(0.5mol·L-1)溶液与50mLNaOH(0.5mol·L-1)溶液在小烧杯中进行中和反应,三次实验温度平均升高4.1℃,已知中和后生成的溶液的比热容为![]() ,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
上述实验数值结果与57.3kJ·mol-1有偏差,产生此偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
实验中若改用60mLH2SO4(0.25mol·L-1)溶液与50mLNaOH(0.55 mol·L-1)溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”、“不相等”),所求中和热 _____ (填“相等”、“不相等”),若用50mL0.5mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ______ (填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应2SO2(g)+O2(g)![]() 2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
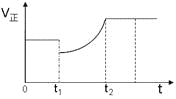
A.t1时减小了SO2的浓度,增加了SO3的浓度
B.t1时降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com