
 2C(g)(△H<0)的是
2C(g)(△H<0)的是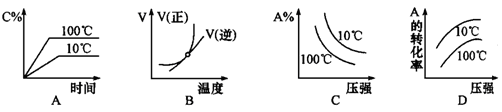
 2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低。反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大。A、由图象可知,温度升高C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,故A错误;B、由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,故B错误;C、由图象可知,压强越大A%降低,平衡向正反应移动。升高温度A%降低,平衡向正反应移动,图象与实际不相符,故C错误;D、由图象可知,压强越大A转化率增大,平衡向正反应移动。升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,故D正确。
2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低。反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大。A、由图象可知,温度升高C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,故A错误;B、由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,故B错误;C、由图象可知,压强越大A%降低,平衡向正反应移动。升高温度A%降低,平衡向正反应移动,图象与实际不相符,故C错误;D、由图象可知,压强越大A转化率增大,平衡向正反应移动。升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,故D正确。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )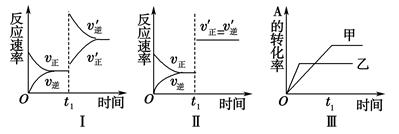
| A.图Ⅰ表示的是t1时刻升高温度对反应速率的影响 |
| B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
| D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1 N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |

| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
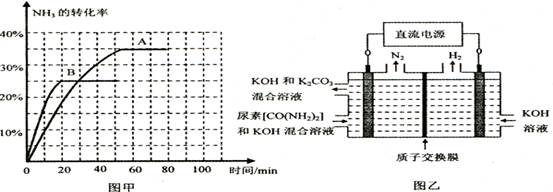
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答: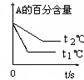
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: 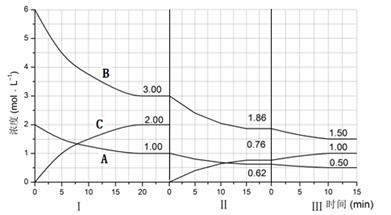
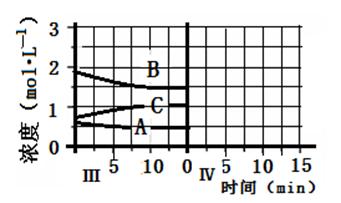
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
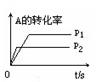
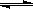 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
| A.图Ⅰ是增大压强的变化情况 |
| B.图Ⅱ是一定是加入催化剂的变化情况 |
| C.图Ⅲ是增大压强或升高温度的变化情况 |
| D.图Ⅲ一定是升高温度的变化情况 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
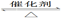 2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是

| A.由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com