
已知:2BrO3- +Cl2=Br2 +2ClO3-;5Cl2 +I2 +6H2O =2HIO3 +10HCl;
ClO3- +5Cl- +6H+ =3Cl2+3H2O判断下列物质氧化能力强弱顺序为
A.ClO3->BrO3->IO3->Cl2 B.BrO3->Cl2>ClO3->IO3-
C.BrO3->ClO3->Cl2>IO3- D.Cl2>BrO3->ClO3->IO3-
科目:高中化学 来源:2015-2016学年山东寿光现代中学高二上12月月考化学卷(解析版) 题型:选择题
常温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目增加,导电性增强
B.醋酸的电离程度增大,[H+]减小
C.再加入10mL pH=11 NaOH溶液,混合液pH=7
D.溶液中由水电离出的[H+]=1×10-11mol•L-1
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列有关物质应用的说法正确的是
A.碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污
B.自来水厂可用明矾对水进行消毒杀菌
C.常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸
D.MgO、Al2O3熔点高,可用于制作耐火材料
查看答案和解析>>
科目:高中化学 来源:2016届云南师范大学附属中学高三上高考适应性月考化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术]
煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:

上述过程中Fe2+的作用为________________。写出Fe2+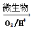 Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
关于下列图示的说法中正确的是:
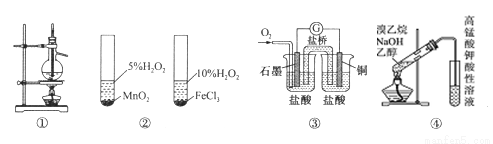
A.图①装置用于分离沸点相关较大的互溶液体混合物
B.图②装置用于研究不同催化剂对反应速率的影响
C.图③中电流计的指针发生偏转,石墨为正极
D.图④装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
运动会上使用的发令枪所用“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式为:5KC1O3+6P =3P2O5+5KC1,则下列有关叙述错误的是( )
A.上述反应中C1的化合价由+5价变为-1价
B.P2O5是P被还原后所得的产物
C.该反应被还原与被氧化物质的物质的量之比为5:6
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:选择题
一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应:
2A(g)+B(g) 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
t/min | 2 | 4 | 6 | 8 | 10 |
n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
A.反应前2 min的平均速率ν(C) =0.02 mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B.电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是
Cu2+、H+、Pb2+
C.含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体
D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:填空题
过渡元素在生活、生产和科技等方面有广泛的用途。
(1)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+________(填“有”或“无”)颜色。
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________。(填序号)
A.PFS中铁显+3价
B.铁原子的外围电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
元素 | Mn | Fe | |
电离能 | I1 | 717 | 759 |
(kJ·mol-1)[ | I2 | 1 509 | 1 561 |
I3 | 3 248 | 2 957 | |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为: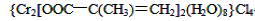
①该化合物中存在的化学键类型有______________________________。
②甲基丙烯酸分子中C原子的杂化方式有________。
③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是________(填一种即可)。
④与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是________(填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com