
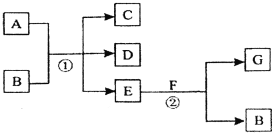
【题目】在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
回答下列问题:
(1)A、G的化学式分别为________________、 ________________。
(2)F和E反应的化学方程式为____________________________。
(3)写出反应①的化学方程式____________________________________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ___________g。
【答案】Cl2 O2 2Na2O2 +2H2O = 4NaOH + O2 Cl2+2NaOH=NaCl+NaClO+H2O 15.6
【解析】
E常温下为无色无味的液体,推测E为水,F为淡黄色粉末,推测为过氧化钠,由图中关系可推知:A:Cl2;B:NaOH;C:NaCl;D:NaClO;E:H2O;F:Na2O2;G:O2。
在结合反应①②的情况,即可推断反应①为:Cl2+2NaOH=NaClO+NaCl+H2O,反应②为2Na2O2+2H2O=4NaOH+O2↑,据此解答。
由图中关系可推知:A:Cl2;B:NaOH;C:NaCl;D:NaClO;E:H2O;F:Na2O2;G:O2。
(1)A、G的化学式分别为Cl2、O2。
故答案为:Cl2 ;O2;
(2)F和E反应的化学方程式为2Na2O2 +2H2O = 4NaOH + O2,
故答案为:2Na2O2 +2H2O = 4NaOH + O2;
(3)A和B反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)在反应2Na2O2 +2H2O = 4NaOH + O2↑,每产生标准状况下的氧气22.4L,消耗的Na2O22mol.即156g。现在产生了2.24 L气体G(标准状况),则消耗Na2O2质量为15.6g,
故答案为:15.6。


科目:高中化学 来源: 题型:
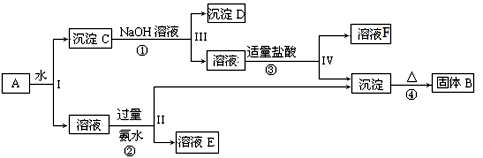
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是______。
(2)根据上图反应关系,写出下列B、F所含物质成分的化学式:B______;F_____。
(3)写出过程反应①的离子方程式_________________,固体B所含对应的金属其单质与磁性氧化铁在高温下反应的化学方程式__________________________。
(4)写出③中盐酸过量时的离子反应方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。已知:NaAlO2+CO2+H2O = Al(OH)3↓+NaHCO3,根据下列框图转化回答问题:
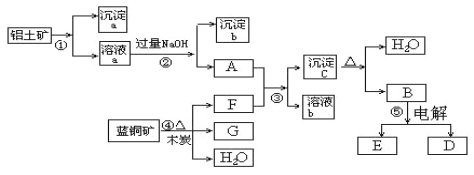
(1)写出②的离子方程式:_________________________、_____________________________。
(2)沉淀a、c化学成分分别是: ___________________、_________________________
(3)请写出检验沉淀b中所含有阳离子的实验方法_____________________________________________________________。
(4)洗涤沉淀c的实验操作方法是_______________________________________________________;加热沉淀c应放在___________(容器)中进行。
(5)经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:________________________________________________、____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A. 甲装置:可用来证明碳酸的酸性比硅酸强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法不能检查此装置的气密性
D. 丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是

A. 若电键K与N连接,铁被保护不会腐蚀
B. 若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C. 若电键K与M连接,铁棒上有黄绿色气体产生
D. 若电键K与M连接,当两极共产生22.4 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)实验需要的玻璃仪器除了烧杯、量筒、玻璃棒,还有_________________;
(2)计算:配制本次实验需要的稀硫酸需用量筒量取上述98%的浓H2SO4______ mL
(3)配制过程:①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀
⑤向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改用胶头滴管加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦将配制好的溶液转移至试剂瓶中待用。
上述配置溶液的步骤存在缺失,缺少的步骤是____________________。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①所用的浓硫酸长时间放置在密封不好的容器中_________;
②量取浓硫酸所用量筒有蒸馏水_________;
③定容时,俯视液面_________;
④用量筒量取浓硫酸时仰视液面___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4gCu与足量的浓硫酸在加热条件下充分反应。
(1)把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的BaCl2溶液,得到沉淀4.66g,则稀释后所得溶液中SO42-的物质的量浓度为_____________。
(2)把产生的气体缓缓通入100 mL a mol/L的NaOH溶液中,若反应物均无剩余,则a的取值范围是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_________________________________。
(2)该反应的正反应为____________反应(填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______________℃。此温度下加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为__________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L ,c(H2)为1.5mol/L,c(CO)为1mol/L, c(H2O)为3mol/L,则正、逆反应速率的比较为υ正________υ逆 。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com