
分析 (1)N原子的核外电子排布式为1s22s22p3,s能级有1个轨道,1s、2s电子为成对电子,2p能级有3个轨道,3个电子各占据1个轨道,是未成对电子;
(2)①NH3分子中N原子呈3个N-H,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
②NH3分子是三角锥型,NH4+是正四面体型,键角不变,NH4+中N原子呈4个N-H,杂化轨道数目为4,采取sp3杂化;
(3)铜离子与水分子、氨气分子之间形成配位键,水分子中O-H键、氨分子中N-H键都是共价键,硫酸铜和一水合氨反应生成氢氧化铜沉淀.
解答 解:(1)N原子的核外电子排布式为1s22s22p3,s能级有1个轨道,1s、2s电子为成对电子,2p能级有3个轨道,3个电子各占据1个轨道,是未成对电子,故未成对电子数与成对电子数之比为3:4,故答案为:3:4;
(2)①NH3分子中N原子呈3个N-H,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化,故答案为:sp3;
②NH3分子是三角锥型,NH4+是正四面体型,键角不变,NH4+中N原子呈4个N-H,杂化轨道数目为4,采取sp3杂化,都采取sp3杂化,故答案为:B;
(3)铜离子与水分子、氨气分子之间形成配位键,水分子中O-H键、氨分子中N-H键都是共价键,生成蓝色沉淀的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:共价键、配位键,Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
点评 本题考查了氨气分子结构,原子核外电子排布式,杂化轨道理论,络合物形成和化学键的形成,题目难度中等.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
 $→_{②}^{NaOH,乙醇}$
$→_{②}^{NaOH,乙醇}$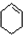 $→_{③}^{Br_{2}的CCl_{4}溶液}$B
$→_{③}^{Br_{2}的CCl_{4}溶液}$B
 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 | 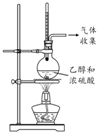 | 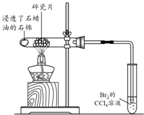 | 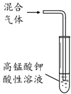 | 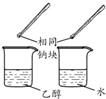 |
| 目的 | 利用乙醇的消去反应制取乙烯 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
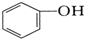 与
与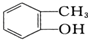
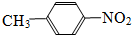 和
和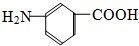
 和
和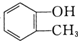
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
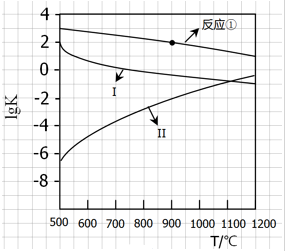 用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.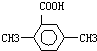 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com