
下图为化学课本上实验室制溴苯的装置,该装置较简单,操作也较简便.请回答下列问题:

(1)苯、溴在烧瓶中混合后现象为________,说明了________.
(2)将铁粉加入几秒钟后,能观察到的现象是:①________,②________.
(3)反应结束后,生成物在________中,如何将其取出?
(4)从整个制备过程来分析,该装置有哪些不足?(至少写出三点)
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
(14分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
(1). B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2).向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,
①请写出铜跟浓硫酸反应的化学方程式:_____________________________,写出C中发生反应的离子方程式 。
②被还原的H2SO4的物质的量
A 小于0.45摩 B等于0.45摩
C 在0.45摩与0.90摩之间 D大于0.90摩
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_________ (填写字母编号,有几个写几个,多写或写错0分)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3) 常温下,将铁棒置于浓硫酸中.无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省福州八中高一下学期期中考试化学试卷 题型:填空题
(14分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
(1). B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2).向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,
①请写出铜跟浓硫酸反应的化学方程式:_____________________________,写出C中发生反应的离子方程式 。
②被还原的H2SO4的物质的量
A 小于0.45摩 B 等于0.45摩
C 在0.45摩与0.90摩之间 D 大于0.90摩
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_______ __ (填写字母编号,有几个写几个,多写或写错0分)。
__ (填写字母编号,有几个写几个,多写或写错0分)。
| A.铁粉 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
 了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。查看答案和解析>>
科目:高中化学 来源:2014届安徽省高三上学期第一次联考化学试卷(解析版) 题型:实验题
某校化学兴趣小组的同学为研究铜与浓硫酸的反应,分别设计了如下图所示的三套实验装置:
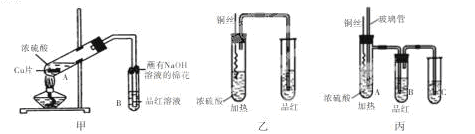
(1)该小组同学对这三套装置进行了评价,认为甲和乙装置各有优缺点,甲装置的优点是 ,乙装置的优点是 。
(2)丙装置综合了甲和乙的优点,是一套比较合理的装置,试管C中是 溶液,A中玻璃管可起到防止B中品红溶液倒吸的作用,其原理是 。
为使装置中残留气体完全被C溶液吸收,可采取的操作是 。
(3)写出丙装置中发生反应的化学方程式: ,该小组同学用丙装置进行实验过程中发现除了课本上描述的实验现象外,试管A内还生成了白色固体,白色固体成分可能是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三年级第一次联考理综化学试卷(解析版) 题型:实验题
草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质, 进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
|
实验步骤(不要求写出具体操作过程) |
预期实验现象和结论 |
|
取少量黑色固体,
|
|
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为: 。

根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
查看答案和解析>>
科目:高中化学 来源:2013届福建省高一下学期期中考试化学试卷 题型:填空题
(14分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:

(1). B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2).向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,
①请写出铜跟浓硫酸反应的化学方程式:_____________________________,写出C中发生反应的离子方程式 。
②被还原的H2SO4的物质的量
A 小于0.45摩 B 等于0.45摩
C 在0.45摩与0.90摩之间 D 大于0.90摩
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_________ (填写字母编号,有几个写几个,多写或写错0分)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3) 常温下,将铁棒置于浓硫酸中.无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com