
【题目】300℃时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)![]() 2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
(1)求该反应的平衡常数____。
(2)求平衡时A的转化率____。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、SO42-、CO32-,现取三份100mL溶液进行如下实验:
a. 第一份加入AgNO3溶液有沉淀产生;
b. 第二份加足量NaOH溶液加热后,收集到气体0.04mol;
c. 第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,回答下列问题
(1)该溶液中一定存在的离子是_____________,可能存在的离子是____________。
(2)求一定存在阳离子的浓度或浓度的取值范围______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应m A(g)+n B(g)![]() p C(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则:
p C(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则:
(1)该反应的逆反应是______热反应,且p ______ m+n (填“>”、“<”或“=”)。
(2)其他条件不变时,增大压强,C的质量分数______,逆反应速率______。(填“增大”、“减小”或“不变”)
(3)其他条件不变时,若加入B(体积不变),则A的转化率______。(填“增大”、“减小”或“不变”)
(4)其他条件不变时,若降低温度,则平衡时B、C的浓度之比c(C)/c(B)比值将______。(填“增大”、“减小”或“不变”)
(5)其他条件不变时,若加入催化剂,该反应的反应热______。(填“增大”、“减小”或“不变”)
(6)若B是有色物质,A、C均为无色物质,维持容器体积不变,充入氖气时,混合气体的颜色______。(填“变浅”、“变深”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发的是
A. 2Ag2O(s)=4Ag(s)+O2(g)
B. 2Fe2O3(s)+3C(s)=Fe(s)+3CO2(g)
C. N2O4(g)=2NO2(g)
D. 6C(s)+6H2O(l)=C6H12O6(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列对晶体结构和性质的认识错误的是______
A.“雪花→水→水蒸气→氧气和氢气”变化中,被破坏的粒子间的作用力依次是:氢键、氢键、极性键
B.晶体CO2和H2O中,微利间相互作用完全相同,晶体类型也相同
C.SiO2晶体最小的环上,有6个Si原子和6个O原子
D.金刚石和石墨的熔点都较高,是因为二者都为原子晶体
II.黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2。
(1)Fe在周期表中的位置为______________________;Fe、S、O原子的第一电离能由大到小的顺序是_________________________。
(2)CuFeS2中Cu元素有________个未成对电子,Cu2S中Cu元素基态时电子排布式为__________。
(3)SO2分子的立体构型为_____________,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是__________________。
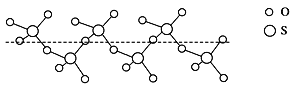
(4)已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS 的原因_________。

(5)Cu的晶胞如图所示,晶体密度为ρ g·cm-3。晶胞中等距最近的Cu原子有_____个,晶胞的边长为___________(用含ρ和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“常见无机物”,主要是指的铝、铁、硫、氯四种元素的单质及化合物。完成下列填空:
(1)四种元素原子的半径大小 Fe> > > 。_________
(2)铝原子最外层电子排布式为_____,核外共有_____种不同运动状态的电子。
(3)实验室制备氯化氢气体的反应:_____。其制备装置和实验室制备_气体类似(填化学式)。
(4)16g 硫磺在过量氧气中燃烧放出 149kJ 的热量,写出该热化学方程式______________。
(5)比较两种化合物熔点高低,氯化钠_____氧化镁,请解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A. 溶质水解反应:HCO3- +H2O![]() H3O++CO32-
H3O++CO32-
B. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C. 微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D. 微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)![]() CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com