
下列对浓硫酸的叙述正确的是
[ ]
A.浓硫酸具有吸水性,实验室中常用作气体干燥剂,但由于浓硫酸又具有强氧化性,因而它不能干燥具有还原性的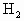 、CO等气体
、CO等气体
B.常温下,浓硫酸能使铁和铝表面钝化,所以铁质与铝质容器能盛放浓硫酸
C.浓硫酸和铜片加热反应,表现出强氧化性,又表现出酸性
D.浓硫酸与亚硫酸钠固体反应制取二氧化硫时,浓硫酸表现出强酸性
科目:高中化学 来源: 题型:阅读理解
 运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义。
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜。该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g) △H=-768.2KJ·mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0KJ·mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的 △H= 。
 (2)硫酸生产中涉及反应:2SO
(2)硫酸生产中涉及反应:2SO![]() (g)+O
(g)+O![]() (g)
(g)![]() 2SO
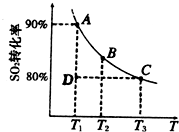
2SO![]() (g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
② 某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol·L-1,则0~10min内的平均反应速率v(SO2)= ,该温度下反应的平衡常数K= 。
③ 下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO![]() 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④ 以下操作将引起平衡向正反应方向移动并能提高SO![]() 转化率的是
转化率的是
A.向容器中通入少量O![]() B.向容器中通入少量SO
B.向容器中通入少量SO![]()
C.使用催化剂 D.升高温度 E.恒容通入少量氦气
⑤ 气体SO2是大气污染物,可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义。
请回答下列问题:
(1)已知:

Al和FeO发生铝热反应的热化学方程式是 。
 (2)硫酸生产中涉及反应:2SO
(2)硫酸生产中涉及反应:2SO![]() (g)+O
(g)+O![]() (g)
(g)![]() 2SO
2SO![]() (g)。
(g)。
① 一定条件下,SO![]() 的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
②下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO![]() 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
③以下操作将引起平衡向正反应方向移动并能提高SO![]() 转化率的是
转化率的是
A.向容器中通入少量O![]() B.向容器中通入少量SO
B.向容器中通入少量SO![]()
C.使用催化剂 D.升高温度 E.恒容通入少量氦气
④气体SO2是大气污染物,可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南外国语学校高三(上)期中化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com