
 ,B+的离子结构示意图
,B+的离子结构示意图 .
.分析 A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数,则A为S元素、B为K元素;C元素的原子只有1个电子,则C为H元素;A、D两元素原子核外电子总数比B元素原子质子数多9个,则D元素原子质子数=19+9-16=12,故D为Mg,据此解答.
解答 解:A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数,则A为S元素、B为K元素;C元素的原子只有1个电子,则C为H元素;A、D两元素原子核外电子总数比B元素原子质子数多9个,则D元素原子质子数=19+9-16=12,故D为Mg,
(1)由上述分析可知,A为S元素、C为H元素,故答案为:S;H;
(2)D为Mg,原子结构示意图为: ;K+离子结构示意图为:
;K+离子结构示意图为: ,
,
故答案为: ;
; ;
;
(3)D离子为Mg2+,核外电子数为10,与Mg2+具有核外电子数且带4个原子核的分子为:NH3,
故答案为:NH3.
点评 本题考查结构与位置关系、原子结构示意图等,比较基础,理解掌握核外电子排布规律,熟记常见10电子微粒,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
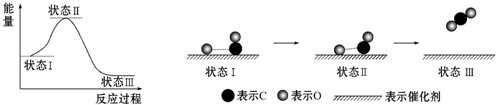
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O反应生成CO2的过程 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应生成CO2的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | Wg该原子中含有$\frac{W}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 小苏打 | 干冰 |
| B | 蒸馏水 | 氨水 | 火碱 | 二氧化硫 |
| C | 硫酸 | 胆矾 | 纯碱 | 氨气 |
| D | 硝酸 | 食盐 | 氢氧化钠溶液 | 生石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量 M=$\frac{22.4mw}{[(1-w)V]}$ | B. | 物质的量浓度 c=$\frac{1000dV}{(MV+22.4m)}$ | ||
| C. | 溶质的质量分数 w=$\frac{MV}{22.4m}$ | D. | 溶液密度 d=$\frac{cM}{1000w}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
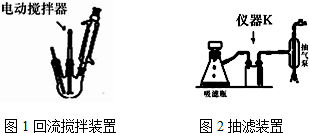

 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com