
【题目】某工业废气中的SO2经如图中的两个循环可分别得到S和H2SO4。下列说法正确的是
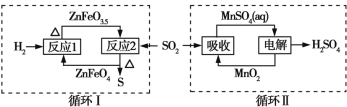
A. 循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
B. 循环Ⅰ中,反应2中的还原产物为ZnFeO4
C. Mn可作为循环Ⅱ中电解过程中的阳极材料
D. 循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
【答案】D
【解析】
A.反应1为2ZnFeO4+H2![]() 2ZnFeO3.5+H2O,氧化产物为H2O,故A错误;
2ZnFeO3.5+H2O,氧化产物为H2O,故A错误;
B.反应2为4ZnFeO3.5+SO2![]() 4ZnFeO4+S,还原产物为S,故B错误;
4ZnFeO4+S,还原产物为S,故B错误;
C.循环Ⅱ中电解时,阳极上Mn2+放电生成MnO2,若Mn作为循环Ⅱ中电解过程中的阳极材料,则阳极上Mn放电,得不到MnO2,故C错误;
D.循环I中总反应为2H2+SO2![]() S+2H2O,循环Ⅱ中电解过程发生反应为MnSO4+2H2O
S+2H2O,循环Ⅱ中电解过程发生反应为MnSO4+2H2O![]() MnO2+H2SO4+H2↑,吸收过程发生反应为MnO2+SO2=MnSO4,故循环Ⅱ中总反应为2H2O+SO2=2H2SO4+H2,循环I和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的物质的量之比为1:1,质量之比为16:49,故D正确。
MnO2+H2SO4+H2↑,吸收过程发生反应为MnO2+SO2=MnSO4,故循环Ⅱ中总反应为2H2O+SO2=2H2SO4+H2,循环I和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的物质的量之比为1:1,质量之比为16:49,故D正确。
故选D。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 2 mol水的摩尔质量为36g/mol
B. 摩尔是用来衡量微观粒子多少的一种物理量
C. 阿伏加德罗常数约为6.02×1023mol-1
D. 1mol·L-1的Na2SO4溶液中,含Na+的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
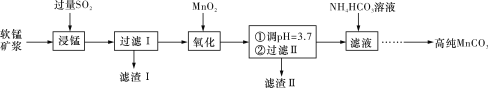
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
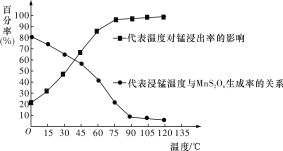
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示的铜-锌原电池,其电解质溶液为硫酸铜溶液。下列关于该电池的说法错误的是
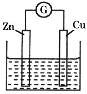
A. 锌电极为负极,发生氧化反应
B. 电子从锌电极经过硫酸铜溶液流向铜电极
C. 铜电极上发生的反应为Cu2++2e-=Cu
D. 电解质溶液中的SO42-向锌电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述或书写正确的是
A. H2(g)+F2 (g)===2HF(g) △H=-270 kJ·mol -1,则相同条件下,2mol HF气体的能量大于1mol氢气和1mol氟气的能量之和
B. 2H2(g)+O2(g)===2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热大于241.8kJ.mol-1
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该中和反应的热化学方程式为NaOH+HCl===NaCl+H2O △H =-57.4kJ·mol-1
D. 500℃、30MPa时,发生反应N2(g)+3H2(g) ![]() 2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置(1)为铁镍(Fe-Ni)可充电电池:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,电极Y附近溶液先变红。下列说法正确的是
Fe(OH)2+2Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,电极Y附近溶液先变红。下列说法正确的是
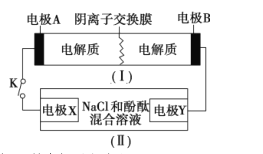
A. 闭合开关K时,电极X的电极反应式为2H++2e-===H2↑
B. 闭合开关K时,电极A的电极反应式为Ni2O3+2e-+2H++H2O===2Ni(OH)2
C. 给装置(I)充电时,电极B上参与反应的物质被氧化
D. 给装置(I)充电时,OH通过阴离子交换膜移向电极A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1mol·L-1四氯金酸( HAuCl4)溶液中滴加0.1mol·L-1NaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法不正确的是
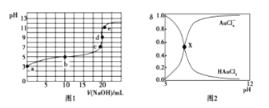
A. b点溶液中存在关系:2c(H+)+ c(HAuCl4)=2c(OH-)+ c(AuCl4-)
B. X点描述的是滴定曲线中b点含氯微粒的物质的量分数δ与pH的关系
C. c点溶液中存在关系:c(Na+)=c(AuCl4-)
D. d点时,溶液中微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对科学家的相关成果的说法正确的是( )
A. 屠呦呦发现抗疟新药青蒿素(C15H22O5),青蒿素属于烃类
B. 闵恩泽研发重油裂解的催化剂,催化裂解可以获得很多重要的化工原料
C. 凯库勒研究了苯环的结构,苯环是碳碳单键和碳碳双键交替的结构
D. 门捷列夫提出元素周期律,元素周期律指元素的性质随相对原子质量的递增而呈周期性的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com