
还原铁粉是粉末冶金工业的重要原料,利用生产钛白的副产品绿矾制备还原铁粉的工业流程如下:
⑴干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为 。
⑵取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为 ,计算FeCO3样品中FeCO3与FeOOH的质量。
⑶若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H210.752 L,计算FexC的化学式。(假设还原铁粉仅含两种物质)
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期质量检测化学试卷 题型:填空题
还原铁粉是粉末冶金工业的重要原料,利用生产钛白的副产品绿矾制备还原铁粉的工业流程如下:
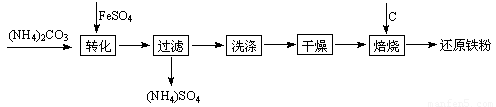
⑴干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为 。
⑵取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为 ,计算FeCO3样品中FeCO3与FeOOH的质量。
⑶若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224 mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752 L,计算FexC的化学式。(假设还原铁粉仅含两种物质)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
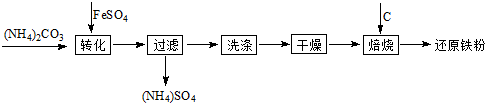
查看答案和解析>>
科目:高中化学 来源:2012届江苏省如皋中学高三上学期质量检测化学试卷 题型:填空题
还原铁粉是粉末冶金工业的重要原料,利用生产钛 白的副产品绿矾制备还原铁粉的工业流程如下:
白的副产品绿矾制备还原铁粉的工业流程如下: 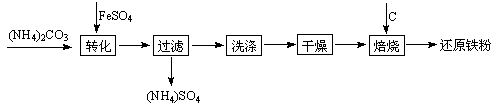
⑴干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为 。
⑵取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为 ,计算FeCO3样品中FeCO3与FeOOH的质量。
⑶若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224 mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752 L,计算FexC的化学式。(假设还原铁粉仅含两种物质)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com