
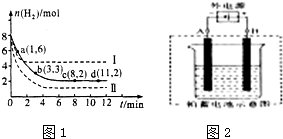
| 6mol |
| 2L |
| 1×1 |
| 2×13 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用干燥的蓝色石蕊试纸 |
| B、用干燥有色布条 |
| C、将气体通入AgNO3溶液 |
| D、用湿润的淀粉碘化钾试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、废弃的金属、纸制品、塑料是可回收资源,玻璃不是可回收资源 |
| B、大力推广农作物的生物防治技术,以减少农药的使用 |
| C、“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D、“低碳生活”倡导生活中耗用能量尽量减少从而减少CO2排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4LNO气体中含有的分子数为NA |
| B、标准状况下,22.4LH2O中含有的水分子数为NA |
| C、常温常压下,11.2LH2中含有的氢分子数为0.5NA |
| D、在标准状况下22.4LCO中含有CO分子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<0 |
| B、反应N2(g)+3H2(g)=2NH3(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动 |
| C、Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| D、纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com