
【题目】氮可以形成多种离子,如N3-、NH2-、N3-、NH4+、N2H5+等。已知N2H5+离子的形成过程类似NH4+的形成过程,N2H5+在碱性溶液中生成电中性的分子和水,试填写下列空白。
(1)该电中性分子的化学式为________________________。
(2)N2H5+离子的电子式为______________________。
(3)写出两种由多原子组成的含有与N3-电子数相同的分子的化学式_______、________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质都会发生变性
B. 氨基酸、蛋白质、油脂都含有C、H、O、N四种元素
C. 生活中食用的食醋、植物油、动物蛋白等物质都是混合物
D. 乙烯、聚乙烯、苯均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
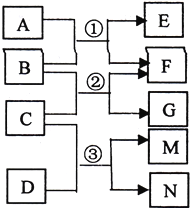
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的合成路线中,已知:
①A为烃类化合物,质谱图表明其相对分子质量为92,红外光谱表明分子中没有碳碳双键,核磁共振氢谱显示A有4组峰,其峰面积之比为3∶2∶2∶1
②E是一种烃,对H2的相对密度为14,所有原子均在一个平面内。
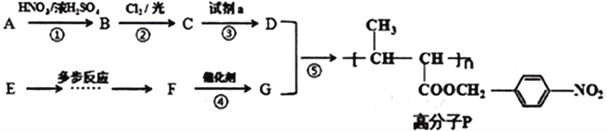
根据以上合成路线回答下列问题:
(1)A物质的名称____________________,步骤③中的试剂a及条件是_______________________。
(2)反应②的化学方程式是________________________________。
(3)F的分子式是C4H6O2,F中含有的官能团名称是__________________________________。
(4)反应①的类型__________________________________。
(5)反应⑤的化学方程式是__________________________________。
(6)与D具有相同的分子式,含硝基(—NO2)且苯环上有两个取代基的同分异构体还有________种(D除外)。
(7)已知:![]() ,以E为起始原料,选用必要的无机试剂合成F,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂与反应条件)______。
,以E为起始原料,选用必要的无机试剂合成F,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂与反应条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如右图所示,其中A、B为多孔材料.下列说法正确的是
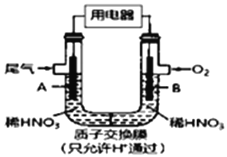
A. 该电池工作时,电子的流向:外电路由B到A
B. 电极B 附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O=NO3-+2H+,NO-3e-+2H2O= NO3-+4H+
D. 该电池工作时,除去含1molNO和NO2的混合尾气,需消耗11.2LO2(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g) ![]() SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。
(1)写出H2O的电子式:___________,SiF4的结构式:____________
(2)在地壳深处容易有___________气体逸出,在地壳浅处容易有___________沉积。该反应的平衡常数表达式为:K=_______________。如果上述反应的平衡常数K值变大,该反应_______(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明乙醇分子中有一个氢原子与其他氢原子不同的是
A.乙醇能燃烧
B.1molCH3CH2OH与Na完全反应只生成0.5molH2
C.乙醇分子中含有一个氧原子
D.乙醇能溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL 0.1 mol.L-1NaOH溶液中逐滴滴加0.2 mol.L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是

A. 水电离出的c(H+):A点小于B点
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)=12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com