
| A. | CH4 | B. | NH3 | C. | H2O | D. | HF |
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{W+n}$(N-n)mol | B. | $\frac{W}{A+n}$(N+n)mol | C. | $\frac{W}{A+n}$(A-N+n)mol | D. | $\frac{W}{A+n}$(N-A-n)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| 待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
| 滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
| 滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
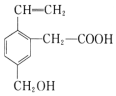
| A. | 有机物的分子式为C11H14O3 | |
| B. | 有机物中含有4种不同的官能团 | |
| C. | 0.5 mol 该有机物与足量NaOH溶液反应,消耗NaOH 1mol | |
| D. | 0.5 mol 该有机物与足量金属钠反应,能生成标准状况下的氢气11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中只含共价键 | |
| B. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 离子化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
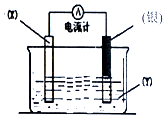 根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:
根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com