
【题目】下列解释工业生产或应用的化学用语中,不正确的是
A. 氯碱工业中制备氯气:2NaCl(熔融) ![]() 2Na + Cl2↑
2Na + Cl2↑
B. 工业制硫酸的主要反应之一:2SO2 + O2 ![]() 2SO3
2SO3
C. 氨氧化法制硝酸的主要反应之一:4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
D. 利用铝热反应焊接铁轨:2Al + Fe2O3 ![]() Al2O3 + 2Fe
Al2O3 + 2Fe
【答案】A
【解析】
本题主要考查化学与生活、生产工业之间的联系。
A.考虑到氯碱工业实质是电解饱和食盐水,而不是电解熔融的氯化钠;
B.工业制备硫酸,主要有三个阶段,分别是:①煅烧黄铁矿:4FeS2+11O2![]() 8SO2+2Fe2O3;
8SO2+2Fe2O3;
② SO2的催化氧化:2SO2 + O2 ![]() 2SO3;③用98.3%的浓硫酸吸收,再稀释的所需浓度的硫酸 SO3 + H2O = H2SO4。
2SO3;③用98.3%的浓硫酸吸收,再稀释的所需浓度的硫酸 SO3 + H2O = H2SO4。
C.工业制硝酸,主要反应为:①氨气的催化氧化:4NH3+5O2![]() 4NO+6H2O;② 2NO+O2=2NO2;③3NO2+H2O=2HNO3+NO;
4NO+6H2O;② 2NO+O2=2NO2;③3NO2+H2O=2HNO3+NO;
D. 利用铝热反应焊接铁轨,主要利用了铝的强还原性,其反应为:2Al + Fe2O3 ![]() Al2O3 + 2Fe。
Al2O3 + 2Fe。
A.以电解食盐水为基础制取氯气等产品的工业称为氯碱工业,则氯碱工业中制备氯气的化学方程式为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,故A错误;
2NaOH+H2↑+Cl2↑,故A错误;
B.工业制硫酸的主要反应之一为二氧化硫的催化氧化,化学方程式为:2SO2 + O2 ![]() 2SO3,故B正确;
2SO3,故B正确;
C.氨氧化法制硝酸的主要反应之一为氨气的催化氧化,化学方程式为:4NH3+5O2![]() 4NO+6H2O,故C正确;
4NO+6H2O,故C正确;
D.工业上可以利用Fe2O3或Fe3O4发生铝热反应焊接铁轨,化学方程式为:2Al + Fe2O3 ![]() Al2O3 + 2Fe,故D正确;
Al2O3 + 2Fe,故D正确;
本题答案选A。


科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是![]()
![]()
①含有金属元素的化合物一定是离子化合物
②第ⅠA族和第ⅦA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤含有离子键的化合物一定是离子化合物
⑥离子化合物中可能同时含有离子键和共价键
⑦非极性键只存在于双原子单质分子中
⑧不同元素组成的多原子分子中的化学键一定都为极性键
A. ①②⑤B. ④⑤⑥C. ①③④D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究草酸亚铁(FeC2O4)的热分解产物,按下面所示装置进行实验。以下说法错误的是

A. 实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO气体
B. 反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C. 装置C的作用是除去混合气中的CO2
D. 反应结束后,应熄灭A、E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于硼对植物花粉管的伸长有重要作用,因此缺硼植物表现出“花而不实”。出现病症后,只要在植株的叶面上喷施一定浓度的含硼溶液,该病症即消失。根据这个事实可以说明硼是
A. 大量元素 B. 微量元素
C. 必需元素 D. 矿质元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol,则该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() =
=![]() ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为______________________。
(2)表中元素原子半径最大的是(写元素符号)_____________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_________。Q与水反应的化学方程式为____。
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2molL-1NaOH溶液和1mol O2,则两种气体的分子式及物质的量分别为____________。生成硫酸铜物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关单质用途的说法不正确的是
A.充有钠蒸气的高压钠灯常用于道路和广场的照明
B.还原铁粉可用作食品袋内的抗氧化剂
C.镁是一种重要的金属材料,是优质的耐高温材料
D.氯气可用于自来水的消毒、药物的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3是一种化工原料,可以通过反应生成一系列物质,如图所示。下列说法正确的是
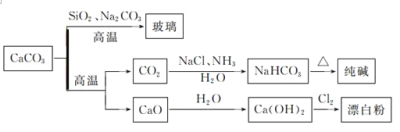
A. ![]() 和
和![]() 均可以漂白有色物质,两者混合使用漂白效果更好。
均可以漂白有色物质,两者混合使用漂白效果更好。
B. 由![]() 可知
可知![]() 的酸性强于
的酸性强于![]()
C. 工业上,可先向饱和食盐水中通入![]() 后再通入
后再通入![]() 制
制![]()
D. 制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com