
分析 (1)O元素的化合价降低,体现氧化性;O元素的化合价既升高又降低;反应中没有化合价的变化,根据强酸制备弱酸分析;
(2)根据氧化剂氧化性大于氧化产物的氧化性判断.
解答 解:A.Na2O2+2HCl═2NaCl+H2O2,该反应中各元素的化合价没有变化,不是氧化还原反应,反应中表现了弱酸性;
B.Ag2O+H2O2═2Ag+O2+H2O,根据化合价的变化知,氧化剂是Ag2O,还原剂是H2O2,Ag2O的氧化性大于H2O2的氧化性;
C.2H2O2═2H2O+O2,根据化合价的变化知,H2O2既是氧化剂又是还原剂;
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O,根据化合价的变化知,H2O2是氧化剂,K2CrO4是氧化产物,
(1)以上反应中H2O2仅体现氧化性的反应为D;以上反应中H2O2既体现氧化性又体现还原性的反应是C;体现酸性的反应是A;
故答案为:D;C;A;
(2)反应Ag2O+H2O2═2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,
反应3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4,
故氧化性顺序为:Ag2O>H2O2>K2CrO4,
故答案为:Ag2O>H2O2>K2CrO4.
点评 本题考查氧化还原反应,侧重氧化还原反应基本概念的考查,把握反应前后元素化合价的变化判断其氧化性、还原性即可,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水煤气反应中,生成1molH2(g)吸收131.4 kJ热量 | |
| B. | CO(g)+H2(g)?C(s)+H2O(g)△H=+131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 | |
| D. | 反应物能量总和大于生成物能量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以天然气为原料合成甲醇常见的方法有水煤气和目前正在开发的直接氧化法
以天然气为原料合成甲醇常见的方法有水煤气和目前正在开发的直接氧化法查看答案和解析>>
科目:高中化学 来源: 题型:解答题

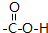 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 石墨烯是从石墨中剥离出来的,其结构如图所示.单层的石墨烯其厚度只有一个碳原子厚,被证实是世界上已经发现的最薄、最坚硬的物质,可制成电阻率最小的纳米材料.下列关于石墨烯的说法正确的是( )
石墨烯是从石墨中剥离出来的,其结构如图所示.单层的石墨烯其厚度只有一个碳原子厚,被证实是世界上已经发现的最薄、最坚硬的物质,可制成电阻率最小的纳米材料.下列关于石墨烯的说法正确的是( )| A. | 石墨烯与金刚石互为同位素 | |
| B. | 从石墨中剥离得石墨烯需克服范德华力 | |
| C. | 石墨烯是高分子化合物 | |
| D. | 制成的纳米材料微粒直径在1nm~100nm,因此石墨烯纳米材料属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象可用于区别溶液与胶体,云、雾、墨水、有色玻璃均能产生丁达尔现象 | |
| B. | 原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团 | |
| C. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| D. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点、溶解度有较大影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne的中子数相同,所以${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne互为同位素 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 | |
| C. | 二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 | |
| D. | C2H6分子中既含极性键又含非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com