
| A. | 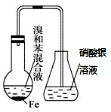 验证苯和液溴在催化剂作用下发生取代反应 | |
| B. | 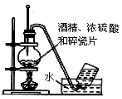 实验室制备并收集乙烯 | |
| C. | 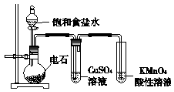 制备乙炔并检验其性质 | |
| D. | 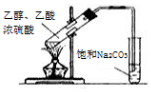 乙醇与乙酸反应制备乙酸乙酯 |
分析 A.溴易挥发,与硝酸银溶液反应;
B.温度计应测定反应液的温度为170℃;
C.食盐水与电石反应生成乙炔,硫酸铜溶液除去杂质硫化氢,乙炔能被高锰酸钾氧化;
D.导管在碳酸钠溶液的液面下,可发生倒吸.
解答 解:A.溴易挥发,与硝酸银溶液反应,HBr也与硝酸银反应,则图中装置不能说明取代反应的发生,故A错误;
B.温度计应测定反应液的温度为170℃,则图中温度计的水银球应在液面下,故B错误;
C.食盐水与电石反应生成乙炔,硫酸铜溶液除去杂质硫化氢,乙炔能被高锰酸钾氧化,则图中装置可制备乙炔并检验其性质,故C正确;
D.导管在碳酸钠溶液的液面下,可发生倒吸,则图中导管应在液面上,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、有机物的制备实验及性质实验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | +5、4 | B. | +5、7 | C. | +5、5 | D. | +7、7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu做还原剂 | B. | H2做氧化剂 | ||
| C. | 铜元素的化合价降低 | D. | 铜是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
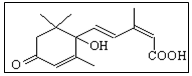 国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A. | 其分子式为C15H18O4 | |
| B. | 分子中存在4种含氧官能团 | |
| C. | 既能发生加聚反应,又能发生缩聚反应 | |
| D. | 1mol该有机物最多可与4molBr2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Cl-、Na+、SCN- | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液中:Al3+、CO32-、Cl-、K+ | |
| C. | 能使甲基橙试剂变黄的溶液:Na+、Cl-、K+、S2O32- | |
| D. | Mg2+、SO42-、I-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,可用于干燥某些气体 | |
| B. | 浓硫酸具有脱水性,可以使纸张碳化 | |
| C. | 浓硫酸具有酸性,可与铜反应生成氢气 | |
| D. | 浓硫酸具有强氧化性,常温下可以使铝片发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量的CO2通入CaCl2溶液中 | 无白色沉淀出现 | 生成Ca(HCO3)2可溶于水 |
| B | 过量的Fe粉加入HNO3溶液中,充分反应后,滴入KSCN溶液 | 有气泡产生,溶液变红 | 有氢气生产,稀将Fe氧化为Fe3+ |
| C | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| D | 将SO2通入Ba(NO3)2中 | 有白色沉淀产生 | 有BaSO4沉淀生产 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com