

分析 图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸,则甲装置是制取氯气,因为浓盐酸易挥发,导致生成的氯气中含有HCl,乙装置是除去氯气中的HCl,丙装置是干燥氯气,在低温下氯气和NaOH反应生成NaCl、NaClO,氯气有毒,且氯气能和NaOH溶液反应,可以用NaOH溶液处理尾气;
(1)浓盐酸和二氧化锰加热制取氯气,所以B中盛放固体药品;氯气和NaOH溶液反应生成NaCl、NaClO;
(2)如果省去乙装置,则氯气中含有HCl,HCl也能和NaOH反应;
(3)氯气有毒,不能直接排空;
(4)Cl2与NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3.
解答 解:图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸,则甲装置是制取氯气,因为浓盐酸易挥发,导致生成的氯气中含有HCl,乙装置是除去氯气中的HCl,丙装置是干燥氯气,在低温下氯气和NaOH反应生成NaCl、NaClO,氯气有毒,且氯气能和NaOH溶液反应,可以用NaOH溶液处理尾气;
(1)浓盐酸和二氧化锰加热制取氯气,所以B中盛放固体药品是MnO2;氯气和NaOH溶液反应生成NaCl、NaClO,则C中应该盛放NaOH溶液才能得到NaClO,故答案为:MnO2;NaOH溶液;
(2)如果省去乙装置,则氯气中含有HCl,HCl也能和NaOH反应,从而降低NaClO的含量,
故答案为:不能;HCl气体进入C中,消耗NaOH,降低NaClO的含量;
(3)氯气有毒,不能直接排空,且氯气能和NaOH溶液反应生成无毒物质,且污染空气,所以应该加上尾气处理装置,
故答案为:需要;应加上尾气处理装置,防止Cl2污染空气;
(4)Cl2与NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3,防止Cl2与NaOH溶液在温度较高时,发生其他反应而导致次氯酸钠含量降低,所以用冰水冷却试管,
故答案为:防止Cl2与NaOH溶液在温度较高时,发生其他反应.
点评 本题考查物质制备,为高频考点,侧重考查学生实验设计、实验操作、实验评价能力,明确实验原理、元素化合物性质是解本题关键,注意题给信息的灵活运用,氯气和NaOH溶液反应时温度不同导致产物不同,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8kJ•mol-1 | |
| B. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1451.6kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-22.68kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-725.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
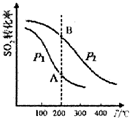 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅①③⑤ | D. | 仅②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 用酸性KMnO4溶液直接检验乙醇与浓硫酸反应的产物是否得到乙烯 | |
| C. | 用燃烧的方法可鉴别甲烷与乙炔 | |
| D. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com