
【题目】下列物质的分类正确的是( )
选项 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | NO |
C | KOH | HNO3 | CaCO3 | CaO | Mn2O7 |
D | NaOH | HCl | CaF2 | Na2O2 | SO2 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】铜~锌原电池,电解质溶液为稀硫酸,当该原电池工作时( )
A.铜电极上发生氧化反应
B.铜电极上发生还原反应
C.电子从铜极经过外电路流向锌极
D.电解质溶液中H+浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 ,
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶;② ;洗涤;③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299g/mol)
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
② 产品中Mg(ClO3)2·6H2O的质量分数为 。(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a:C ![]() CO+H2
CO+H2 ![]() CO2+H2O
CO2+H2O
途径b:C ![]() CO2
CO2
C.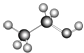 可以表示乙醇分子的球棍模型
可以表示乙醇分子的球棍模型
D.![]() :既可以表示甲烷分子,也可以表示四氯化碳分子
:既可以表示甲烷分子,也可以表示四氯化碳分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:
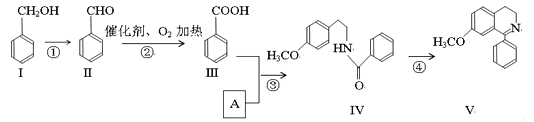
(1)写出Ⅳ中含氧官能团的名称_____________________。
(2)写出Ⅳ物质的分子式_____________。
(3)写出下列反应的类型②___________,③________________。
(4)反应②的化学方程式___________________________________。
(5)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式__________________________。
(6)A的结构简式_______________________。
(7)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式________________________。
(8)一定条件下,化合物Ⅶ(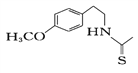 )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式__________________________________。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.A原子的最外层电子比B原子的最外层电子少2个,B原子的质子数是其电子层数的4倍.A、B、C三种元素能结合成化合物C2AB3,在lmolC2AB3中共有52mol电子。D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移。E元素的单质是一种黄绿色气体,水溶液具有漂白性。试填写下列空白:
(l)写出元素A 和E 的名称:A , E 。
(2)元素B在周期表中的位置为第二周期 族.
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为含有 键(填“极性”或“非极性”)的 化合物(填“离子”或“共价”) ,写出该化合物的电子式 。
(4)写出C、D两种元素对应的最高价氧化物的水化物相互反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六种短周期元素在元素周期表中的相对位置如图所示,其中R元素的最外层电子数是其次外层电子数的一半。
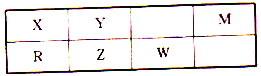
请回答下列问题:
(1)R的元素名称是_______,中子数为8的X元素的原子是______(用原子组成符号表示)。
(2)上述六种元素,非金属性最强的元素为________________(填元素符号)
(3)Z的最高价氧化物对应水化物的化学式为____________________。
(4)W和Y形成一种二元化合物甲的相对分子质量为184,且Y的质量分数约为30%。则化合物甲的化学式为__________________。化合物甲在摩擦时会发生猛烈爆炸,分解为一种W的单质和一种Y的单质,其中W的单质与Y的单质的相对分子质量之比为64∶7。写出化合物甲爆炸分解的化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取铁粉和氧化铜的混合物6.40g,进行如下实验: 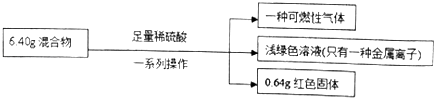
根据实验所得数据,下列说法不正确的是( )
A.原混合物中铜元素的质量一定为0.64g
B.生成气体体积为2.016L
C.实验中反应的硫酸的物质的量为0.1mol
D.原混合物中铁的质量分数为87.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com