
【题目】我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R 代表)。回答下列问题:
(1)基态N 原子中,核外电子占据的最高能层的符号是______________,占据该能层电子的电子云轮廓图形状为_______________________________。
(2)N 和O 两种元素第一电离能大小关系是N__________( 填“ >”“ <” 或“ =” )O,其原因是____________;N 和O两种元素电负性大小关系是N_______(填“ >”“ <” 或“=” )O。
(3)经X-射线衍射测得化合物R 的晶体结构,其局部结构如下图所示。

①组成化合物R 的两种阳离子中σ键的个数之比为_________;其中四核阳离子的立体构型为___________,其中心原子的杂化轨道类型是_______________________。
②分子中的大π键可用符号![]() 表示,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为
表示,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为![]() 。则N5-中的大π键应表示为___________________。
。则N5-中的大π键应表示为___________________。
③氢键通常用X-H…···Y 表示,请表示出上图中的所有氧键:_________________。
④R的立方晶胞参数为a nm,晶胞中含有Y个(N5)6(H3O)3(NH4)4Cl 单元,如果(N5)6(H3O)3(NH4)4Cl的相对分子质量用M 表示,阿伏加德罗常数的值为NA,则R 晶体的密度为________g·cm-3。
【答案】 L 球形和哑铃形 > N原子2P能级处于半充满状态,相对稳定,失去一个电子吸收的能量较大 < 3:4(或4:3) 三角锥形 sp3 ![]() N-H···N、O-H····N、N-H···Cl
N-H···N、O-H····N、N-H···Cl 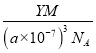
【解析】(1)基态N原子的电子排布式为1s22s22p3,核外电子占据的最高能层的符号是L,L能层中s能级电子云轮廓图形状为球形、p能级电子云轮廓图形状为哑铃形,故答案为:L;球形和哑铃形;
(2)N的2p为半充满结构,较为稳定,第一电离能:N>O;N的非金属性比O小,非金属性越强,电负性数值越大,电负性:N<O,故答案为:>; N原子2P能级处于半充满状态,相对稳定,失去一个电子吸收的能量较大;<;
(3)①根据图(b),阳离子为H3O+和NH4+,NH4+中心原子N含有4个σ键,H3O+中心原子是O,含有3σ键,σ键的个数之比为3:4(或4:3);其中四核阳离子为H3O+,H3O+中心原子是O,含有3σ键,孤电子对数为![]() =1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形,故答案为:;三角锥形;sp3;
=1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形,故答案为:;三角锥形;sp3;
②根据图(b)N5-中键总数为5个,根据信息,N5-有6个电子可形成大π键,可用符号Π56表示,故答案为:Π56;
③根据图示,其中的氢键可表示为O-H…N、N-H…N,以及N-H···Cl,故答案为: O-H…N、N-H…N、N-H···Cl;
④R的立方晶胞参数为anm,晶胞中含有Y个(N5)6(H3O)3(NH4)4Cl单元,如果(N5)6(H3O)3(NH4)4Cl的相对分子质量用M表示,阿伏加德罗常数的值为NA,则R晶体的密度=![]() =
=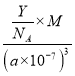 =
=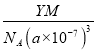 g·cm-3,故答案为:
g·cm-3,故答案为: 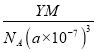 。
。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】CN-可以造成水体污染,某小组采用如下方法对污水进行处理。
Ⅰ![]() 双氧水氧化法除NaCN。
双氧水氧化法除NaCN。
(1)NaCN的电子式为____________________________。
(2)碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为________________。
Ⅱ.CN-和Cr2O72-联合废水处理法。
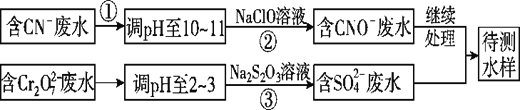
(3)②中反应后无气体放出,该反应的离子方程式为_____________________。
(4)步骤③中,每处理0.4mol Cr2O72-,至少消耗Na2S2O3________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年诺贝尔化学奖授予"手性碳原子的催化氢化,氧化反应"研究领域作出贡献的美,日三位科学家,手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是
A.CBr2F2 B.CH3CH2OH
C.CH3CH2CH3 D.CH3CH(OH)COOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学用语是学习化学的重要工具。请按要求用化学用语填空:
①2个铜原子___________。
②5个氢氧根离子______________。
③最理想能源的气体单质_________________。
④氧化铝中铝元素的化合价为+3价________。
⑤可用于人工降雨的干冰______________。
(2)生活处处有化学,请联系学过的化学知识。回答下列问题:
①包饺子的食材有面粉、韭草、瘦肉、植物油、食盐等。其中富含糖类的是_________。
②人体缺____元素能导致儿童发育不良或佝偻病,老年人会导致骨质疏松。
③加了洗涤剂的水能除去衣服上的油污,是利用了洗涤剂的__________作用。
④铁锅容易生锈的主要原因是铁与空气中的________、水蒸气发生了化学反应。
⑤玻璃杯、塑料盆、不锈钢餐具等是生活中常见的日用品,其中属于有机合成材料制成的是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某固体物质可能含有氯化钾、硫酸铜、氢氧化钠、硝酸镁,硫酸钠中的一种或几种,为鉴定它们,做如下实验:
①将该固体物质全部溶解于水中,得到无色溶液a。
②取少量a溶液于试管中,向其中滴加少量硫酸铁溶液,产生红褐色沉淀
③另取少量a溶液于试管中,向其中滴加少量的硝酸钡溶液,产生白色沉淀
步骤③中发生反应的化学方程式__________________________。据此推断,该固体物质中一定含有(以下写化学式,下同)______________,一定不含有________________,可能含有_____。
(2)下图是初中化学常见六种物质之间的关系图(物质是溶液的只考虑溶质)。图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。
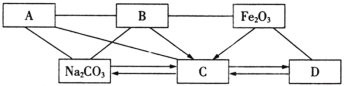
A是一种碱,其中阳离子是人体骨骼中的主要成分,B是胃酸的主要成分。C、D中所含元素种类相同。
①请分别写出A、B、C、D物质的化学式(或溶质的化学式):
A.___________ B.___________ C.___________ D.___________;
②写出Fe2O3反应生成C物质的化学方程式___________________________(写一个);
③写出Fe2O3与足量B反应的实验现象_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(t℃)时,测得0.01 molL-1的NaOH溶液的pH=11,则该温度下水的离子积Kw=________;在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va:Vb=__________;
(2)若所得混合液为中性,且a+b=12,则Va:Vb=__________;
(3)若所得混合液的pH=10,且a=12,b=2,则Va:Vb=__________;
(4)有两瓶pH=2的酸溶液,一瓶为强酸,一瓶为弱酸。现只有石蕊试液、酚酞试液、pH试纸和蒸馏水,而没有其他试剂。简述如何用最简单的方法来确定哪瓶为强酸。所选试剂是__________;采用的方法为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2 气体和 SO3 气体相比较,下列叙述中正确的是
A. 物质的量之比为 4:5 B. 密度比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取NaCl和KCl的混合物25g,溶于水配成溶液,加入体积为1L 0.42mol·L-1的AgNO3溶液,充分反应后过滤出沉淀,再向滤液中加入100gCu片,反应完全后,取出Cu片,洗涤干燥称其重量为101.52g,求原混合物中NaCl和KCl的物质的量各为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1) 碳在形成化合物时,其键型以共价键为主,原因是___________________________。
(2) (CN)2分子中,共价键的类型有________________,C原子的杂化轨道类型是____________
(3) CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于________晶体。
(4) 与碳同族的基态Ge原子的核外电子排布式为___________,有________个未成对电子。
(5) 石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+xLi++xe→LiC6。其结果是:Li+嵌入石墨的A、B层间。现有某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式:_______。

(6) 碳有多种同素异形体,其中金刚石的晶体晶胞如下图所示:
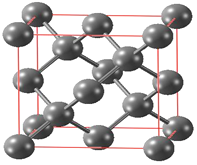
已知金刚石立方晶胞边长a pm,请计算晶体密度____________g/cm3(请用含a和NA的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com