
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 溴单质易溶于四氯化碳 | Br2、CCl4均为非极性分子 |
| B | CO2属于非极性分子 | 分子中只存在非极性共价键 |
| C | 氟化氢高温时也难分解 | HF分子之间存在氢键 |
| D | 碘沸点低、易升华 | 分子中的 I-I 键能较小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.非极性分子易溶于非极性溶剂;
B.不同非金属原子之间形成极性键;
C.分子的稳定性与共价键的强弱有关;
D.分子晶体的熔沸点与分子间作用力有关.
解答 解:A.非极性分子易溶于非极性溶剂,Br2、CCl4均为非极性分子,所以溴单质易溶于四氯化碳,故A正确;
B.不同非金属原子之间形成极性键,CO2中存在极性键,由于分子结构对称正负电荷中心重叠,属于非极性分子,故B错误;
C.分子的稳定性与共价键的强弱有关,氟化氢高温时也难分解,是因为H-F键很稳定,与氢键无关,故C错误;
D.分子晶体的熔沸点与分子间作用力有关,碘沸点低、易升华是因为分子间作用力低,与共价键无关,故D错误.
故选A.
点评 本题考查了化学键、分子间作用力、氢键等,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握分子极性与键的极性的判断方法.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:实验题
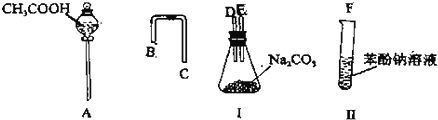
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 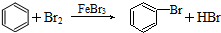 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | L层上的电子数为奇数的元素一定是主族元素 | |
| B. | 族序数等于周期序数的元素一定是金属元素 | |
| C. | 由不同种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 共价化合物只含有共价键,离子化合物只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | M |
| A | H2SO4(浓) | Fe2(SO4)3 | FeSO4 | Fe |
| B | O2 | CO2 | CO | C |
| C | Al | Al(OH)3 | NaAlO2 | NaOH |
| D | NaOH | Na2CO3 | NaHCO3 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
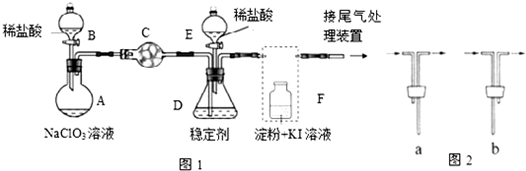
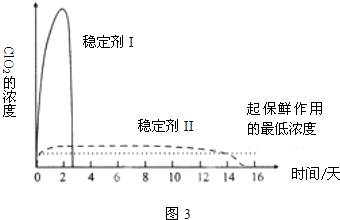
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com