
| A. | 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 | |
| B. | 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极 | |
| C. | 纯银在空气中久置变黑发生的是化学腐蚀 | |
| D. | 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
分析 A.锌、铁和海水构成原电池,锌为负极,被消耗,铁为正极,被保护;
B.原电池工作时负极失去电子,电流由正极经外电路流向负极,原电池中电解质溶液流向正极;
C.因在空气中发生化学腐蚀,生成硫化银;
D.镀铜时,Cu为阳极,失去电子.
解答 解:A.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,锌、铁和海水构成原电池,锌作负极,铁作正极被保护,该保护方法为牺牲阳极的阴极保护法,故A正确;
B.电流的方向与电子的运动方向相反,原电池工作时电流由正极经外电路流向负极,原电池中电流流向为电解质溶液到正极,故B正确;
C.纯银在空气中久置变黑发生化学腐蚀,生成硫化银,故C正确;
D.镀铜时,Cu为阳极,失去电子,而铁制品作电镀池的阴极,铜盐为电镀液,故D错误;
故选D.
点评 本题考查了原电池和电解池的原理,题目难度不大,明确原电池中正负极的判断方法和电解原理以及电流的移动是解题关键,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| B. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| C. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| D. | 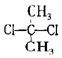 与 与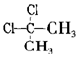 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂中必定有元素化合价升高被氧化 | |
| B. | 通电后,氢氧化铁胶体向阴极运动 | |
| C. | 物质所含元素化合价升高的反应叫还原反应 | |
| D. | 胶体与其他分散系的本质区别是可以发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2晶体中共含有4NA个离子 | |
| B. | 0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| C. | 常温常压下16gO2和O3混合气体含有NA个氧原子 | |
| D. | 1mol/LNa2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com