

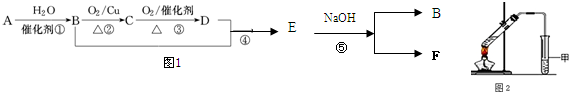
分析 (1)氨气极易溶于水,将胶头滴管中的水挤入集气瓶,引发喷泉;
(2)氯水进入C中,发生氧化还原反应生成氯化铁;
(3)氯水进入E中,发生氧化还原反应生成NaCl、NaClO和水;
(4)氯水进入G中,与KI发生氧化还原反应生成碘单质.
解答 解:(1)氨气极易溶于水,将胶头滴管中的水挤入集气瓶,引发喷泉,则观察到B中无色溶液倒吸入A中,且变为红色,溶液变红是因发生电离反应为NH3•H2O?NH4++OH-,氨气与水反应生成一水合氨,方程式:NH3+H2O?NH3•H2O?;
故答案为:B中无色溶液倒吸入A中,且变为红色;NH3+H2O?NH3•H2O?;
(2)氯水进入C中,发生氧化还原反应生成氯化铁,观察到C中溶液由浅绿色变为黄色,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:溶液由浅绿色变为黄色;2Fe2++Cl2=2Fe3++2Cl-;
(3)氯水进入E中,发生氧化还原反应生成NaCl、NaClO和水,观察到E中溶液红色褪去,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:溶液红色褪去;Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯水进入G中,与KI发生氧化还原反应生成碘单质,淀粉遇碘变蓝,观察到G中溶液变为蓝色,发生的离子反应为Cl2+2I-=I2+2Cl-,
故答案为:溶液变为蓝色;Cl2+2I-=I2+2Cl-.
点评 本题考查了实验装置的综合及离子反应,明确氨气、氯气性质是解题关键,实验引发装置为A,通过氨气发生喷泉实验而引发倒吸发生一系列反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol苯乙烯( )中含有的C=C数为4NA )中含有的C=C数为4NA | |
| B. | 在标准状况下,11.2 L己烷含有分子数为0.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| D. | 1mol甲基含10NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
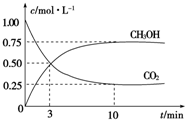 2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.
2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

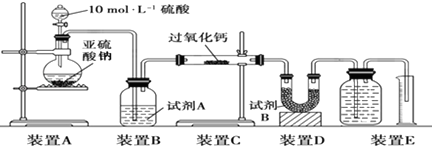
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 想该溶液中加入足量稀盐酸 | 生成白色沉淀并在标准状况下放出0.56L气体 |
| Ⅱ | 将Ⅰ中产生的混合液过滤,将沉淀洗涤、灼烧至恒重,称量所得固体的质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ中所得的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol•L-1 | ? | 0.25mol/L | 0.4mol/L | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH═CH2 | B. | 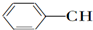 ═CH2 ═CH2 | C. | 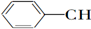 ═CH-CH2 ═CH-CH2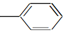 | D. | 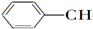 ═CH-CH═ ═CH-CH═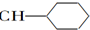 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com