
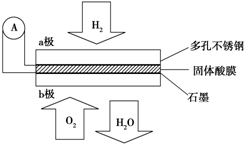
分析 根据图形可知,通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O,电池总反应:2H2+O2=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,以此解答该题.
解答 解:根据图形可知,通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O,电池总反应:2H2+O2=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,
(1)a为负极,b是正极,氧气得电子发生还原反应,电极反应为O2+4e-+4H+=2H2O,故答案为:负;O2+4e-+4H+=2H2O;
(2)通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O,电池总反应:2H2+O2=2H2O,故答案为:2H2+O2=2H2O;
(3)a极反应为H2-2e-═2H+,每转移0.1mol电子,消耗0.05mol的H2,在标况下的体积为1.12 L,故答案为:1.12.
点评 该题是高考中的常见题型,侧重考查学生灵活运用原电池原理解决实际问题的能力,学习中要能正确判断原电池的正负极,以及电极反应式的书写等问题.


科目:高中化学 来源: 题型:选择题
| A. | 氧化镁中混有氧化铝 | B. | 氯化铝溶液中混有氯化铁 | ||
| C. | 氧化铁中混有二氧化硅 | D. | 氯化亚铁溶液中混有氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
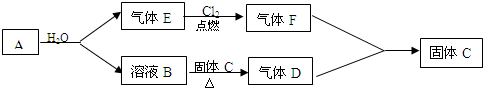

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 安全气囊中原料的配比为$\frac{n(Na{N}_{3})}{n(KN{O}_{3})}$=5 | |
| B. | 若在标准状况下,产生44.8L N2,则有0.25mol KNO3参与反应 | |
| C. | 上述复分解反应发生速度很快,瞬间能产生大量气体 | |
| D. | 根据安全气囊打开时产生气体的体积(标准状况),可大致计算出气囊中原料的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料,且是制造光缆的主要材料 | |
| B. | SiO2不溶于水,也不溶于任何酸 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| D. | 硅胶可用作催化剂的载体和袋装食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
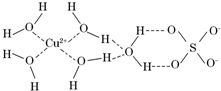 第四周期的许多金属能形成配合物.科学家通过X射线测得胆矾结构示意图可简单表示如下:
第四周期的许多金属能形成配合物.科学家通过X射线测得胆矾结构示意图可简单表示如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X 的简单气态氢化物的热稳定性比W 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 元素X 的简单气态氢化物的沸点比W的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
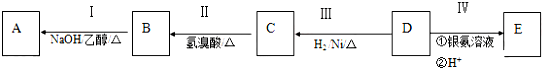
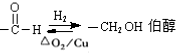

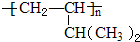
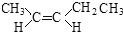
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com