
��10�֣����¶�һ���������£���һ�ܱ������м���4mol SO2��3 mol O2��������Ӧ��2 SO2 (g) + O2 (g)  2 SO3 (g) ��H<O���ﵽƽ���������a mol SO3��[��Դ:ѧ_��_��]
2 SO3 (g) ��H<O���ﵽƽ���������a mol SO3��[��Դ:ѧ_��_��]
(1) �¶����ߣ��÷�Ӧ�Ļ�ѧƽ�ⳣKֵ___________(������С����������Ҳ���ܼ�С)��
��2��SO2��ת����Ϊ (����ĸa�ı���ʽ��ʾ)
��3�����÷�Ӧ���ں��º�ѹ���ܱ������н��еġ��ּ���8mol SO2��6mol O2���ﵽƽ���SO3��������ʵ���Ϊ  mol (����ĸa��ʾ)������ͬ���������£�����3mol SO2��3mol O2��x molSO3���壬��ƽ���SO3�ڷ�Ӧ������е����������ԭƽ����ͬ����x= ��ƽ���SO3�����ʵ����� mol��(�ú�a�ı���ʽ��ʾ)
mol (����ĸa��ʾ)������ͬ���������£�����3mol SO2��3mol O2��x molSO3���壬��ƽ���SO3�ڷ�Ӧ������е����������ԭƽ����ͬ����x= ��ƽ���SO3�����ʵ����� mol��(�ú�a�ı���ʽ��ʾ)
 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
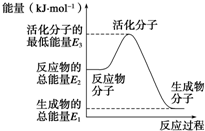 ��֪����N2��g��+O2��g���T2NO��g����H1=+180kJ?mol-1
��֪����N2��g��+O2��g���T2NO��g����H1=+180kJ?mol-1| A����Ӧ���е������仯��ͼ��ʾ�����H2=E1-E3 | B��H2��ȼ����Ϊ241.8 kJ?mol-1 | C���ɷ�Ӧ��֪���¶�һ���������£���һ�����ܱ�������ͨ��1 mol N2��3 mol H2����Ӧ��ų�������ΪQ1 kJ����ͨ��2 mol N2��6 mol H2��ַ�Ӧ��ų�������ΪQ2 kJ����184.8��Q2��2Q1 | D�����Ĵ�������ӦΪ4NH3��g��+5O2��g���T4NO��g��+6H2O��g����H=+906 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪����N2(g)��O2(g)=2NO(g)����H1����180 kJ��mol��1
��N2(g)��3H2(g)  2NH3(g)����H2����92.4 kJ��mol��1
2NH3(g)����H2����92.4 kJ��mol��1
��2H2(g)��O2(g)=2H2O(g)����H3����483.6 kJ��mol��1
����˵����ȷ����( ��)
A����Ӧ���е������仯��ͼ��ʾ����H2��E1��E3
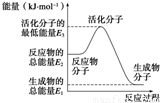
B��H2��ȼ����Ϊ241.8 kJ��mol��1
C���ɷ�Ӧ��֪���¶�һ���������£���һ�����ܱ�������ͨ��1 mol N2��3 mol H2����Ӧ��ų�������ΪQ1 kJ����ͨ��2 mol N2��6 mol H2��ַ�Ӧ��ų�������ΪQ2 kJ����184.8>Q2>2Q1
D�����Ĵ�������ӦΪ4NH3(g)��5O2(g)=4NO(g)��6H2O(g) ��H����906 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�긣��ʡ�߶���ѧ�����п��Ի�ѧ�� ���ͣ�ѡ����
��2molA��1molB���װ���ݻ��ɱ���ܱ������У�������Ӧ��aA��s��+bB��g�� cC��g���ﵽ��ѧƽ���C�����ʵ���Ũ��Ϊkmol��L��1�������¶�һ���������£����ܱ������ݻ���Ϊԭ����1/2��C�����ʵ���Ũ��Ϊ2kmol��L��1����ʼ�ղ��䡣��b��c��ϵ��
cC��g���ﵽ��ѧƽ���C�����ʵ���Ũ��Ϊkmol��L��1�������¶�һ���������£����ܱ������ݻ���Ϊԭ����1/2��C�����ʵ���Ũ��Ϊ2kmol��L��1����ʼ�ղ��䡣��b��c��ϵ��
A��a +b =c B��b=c C�� a+ b >c D��b>C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�����ʡ�߶���ѧ�����п��Ի�ѧ�� ���ͣ�ѡ����
��2molA��1molB���װ���ݻ��ɱ���ܱ������У�������Ӧ��
2A��s��+bB��g��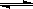 cC��g��
cC��g��
�ﵽ��ѧƽ���C�����ʵ���Ũ��Ϊamol��L��1�������¶�һ���������£����ܱ������ݻ���Ϊԭ����1/2��C�����ʵ���Ũ��Ϊ2amol��L��1����ʼ�ղ��䡣��b��c��ϵ�ǣ� ��
��A��b+2=c B��b=c C��b+2>c D��b<c
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com