
【题目】黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,由硫与氯气再50℃~60℃直接化合而成。装置图如下:

(1)二氯化二硫遇水会反应,生成硫、二氧化硫和刺鼻的酸雾,其化学方程式为______。
(2)A装置中所盛试剂为__________。
(3)操作过程中:
①先通入N2,理由是_________________。
②通入少量Cl2后,装置B采用________(填“水浴”或“油浴”)加热1h。
③停止加热,加大通入氯气量,维持16h。制备二氯化二硫为______(填“放热”或“吸热”)反应。
(4)二氯化二硫的电子式为______________。
(5)装置C的作用是__________,同时制得有价值的工业产品为___________。
(6)为了得到更纯净的二硫化二氯,需要在装置B、C之间安装干燥管,其内盛试剂为____。
【答案】 2S2Cl2+2H2O=SO2↑+3S↓+4HCl 浓硫酸 排走氧气,防止硫加热时与氧气反应 水浴 放热 ![]() 吸收多余的氯气 漂白粉(漂粉精) 氯化钙(五氧化二磷)
吸收多余的氯气 漂白粉(漂粉精) 氯化钙(五氧化二磷)
【解析】(1)二氯化二硫遇水会反应,生成硫、二氧化硫和刺鼻的酸雾为氯化氢气体形成的盐酸小液滴,反应的化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故答案为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl;
(2)二氯化二硫遇水会反应,装置B中制备二氯化二硫不能含水蒸气,通入的氯气需要浓硫酸干燥,故答案为:浓硫酸;
(3)①先通入氮气排净装置中空气,避免硫单质和空气中氧气发生反应,故答案为:防止硫加热时与氧气反应;
②硫与氯气在50~60℃直接化合生成二氯化二硫,控制此温度需要水浴加热,故答案为:水浴;
③停止加热,加大通入氯气量,维持16h,说明反应过程中是放热反应,反应放出的热量保证反应继续进行,故答案为:放热;
(4)S2Cl2是展开书页型结构,Cl-S位于两个书页面内,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)氯气和碱溶液反应,装置C的作用是用来吸收剩余氯气,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,是工业漂白粉的制备原理,故答案为:吸收多余氯气;漂白粉或漂粉精;
(6)为了得到更纯的二氯化二硫,需要在装置B、C之间安装干燥管,其内盛试剂选择中性或酸性固体干燥剂,选择氯化钙或五氧化二磷做干燥剂,故答案为:氯化钙或五氧化二磷。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单双键交替结构可以作为证据的事实是
①苯不能使酸性高锰酸钾溶液褪色
②苯能在一定条件下跟氢气发生加成反应生成环己烷
③经实验测得邻二甲苯(![]() )只有一种结构
)只有一种结构
④苯在FeBr3存在下同液溴可发生取代反应,但不随溴水褪色
A. ②③④ B. ①②④ C. ①③④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是
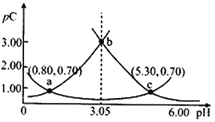
A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,![]() =104.50
=104.50
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>① c.质量②>③>①>④ d.氢原子个数①>③>④>②
A. abc B. bcd C. abcd D. acd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是重要的燃料和工业原料。目前,对CO的综合利用是科学家研究的热点。回答下列问题:
Ⅰ.工业制备CO的方法之一是甲烷氧化法。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol
③2CO(g)+O2(g)=2CO2(g) △H=-330 kJ/mol
(1)反应2CH4(g)+O2(g)=2CO(g)+4H2(g),△H=_________kJ/mol。
Ⅱ.CO也是制备AlCl3的副产品
制备AlCl3的原理为:2Al2O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g) △H1
4AlCl3(g)+3O2(g) △H1
(2)已知该反应在较低温度下不能自发进行,则△H1_____0(填“>”“<”或“=”)
(3)制备AlCl3的实际生产过程中,常加入足量的碳粉,同时生成CO(g)。T1℃时,向恒容的密闭容器中加入5molAl2O3(s)、14molC(s)和6.4molCl2(g)发生反应。Cl2(g)的浓度变化如图(a)所示;图b为20min后改变容器中条件,平衡体系的反应速率(![]() )随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。
)随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。

①容器中发生反应的化学方程式为______________________________。
②0~15min内,用CO表示的该反应平均速率![]() =__________mol/(Lmin)
=__________mol/(Lmin)
③T1℃时,该反应的平衡常数K=______________(不需带单位)。
④40min时的平衡常数[K(40)]与15min时的平衡常数[K(15)]的大小关系:K(40)____K(15)(填“>”“<”或“=”)
⑤45min时,改变的条件为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.硫酸的摩尔质量是98g
B.1mol N2的质量为28g/mol
C.摩尔是物质的量的单位
D.1mol氧的质量等于16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非典型肺炎是由病毒感染引起的。不少群众购买醋精用于室内消毒灭菌,这是因为醋精( )
A. 沸点低 B. 能使蛋白质变性
C. 有酸性 D. 具有医疗保健作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z由如下反应得到:C4H9Br![]() Y
Y![]() Z,Z的结构简式不可能是( )
Z,Z的结构简式不可能是( )
A.CH3CH2CHBrCH2Br
B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3
D.CH2BrCBr(CH3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com